Don't wanna be here? Send us removal request.
Photo

Természetesen a beteg az első, de egyre kevésbé hagyhatjuk figyelmen kívül tevékenységeink természetre gyakorolt hatását. 1 óra Desflurán anesztézia például annyi CO2 kibocsátással jár, mint 370km autózás. A rutinszerűen használt altatógázok közül a Desflurán a leginkább környezetszennyezőbb. Azt is érdemes tudni, hogy a N2O hozzáadása is növeli szén-dioxid kibocsátást Sevoflurán mellett, a Desflurán mellett viszont javít a helyzeten. E kettővel való spórlolással tudunk a legtöbbet tenni környezetünkért.
Részletes BJAE összefoglaló, ha valakit érdekel a témahttps://bjaed.org/article/S2058-5349(17)30142-7/pdf https://www.thelancet.com/journals/lanplh/article/PIIS2542-5196(17)30040-2/fulltexthttps://insights.ovid.com/pubmed?pmid=20519425
0 notes
Photo

Mennyire csökkentsem? Vagy inkább növeljem? Ideális vérnyomás akut ischaemiás strokeban – a MAPAS vizsgálat
A jelenlegi irányelvek meglehetősen liberálisan 220hgmm alatti vérnyomást javasolnak, ha trombolízis nem jön szóba akut stroke esetén. A magas vérnyomás esetén vérzéses transzformációtól, alacsony esetén a még menthető penubra perfúziójától tartunk. De mi is lenne az ideális?
A képen részletezett eredmények alapján szignifikáns különbség a neurológiai kimenetelben nincs, talán picit hátrányosabbnak tűnik a 180 feletti csoport, de ok-okozati összefüggést ez egyáltalán nem igazol.
Érdekes, hogyha azokat hasonlították össze, akiknél gyógyszeres vérnyomásmódosításra volt szükség, azokkal akiknél nem, akkor jobban jártak, azok, akik nem kaptak külön erre gyógyszert.
A vizsgálat minden limitációja (nem vak, kevés beteg, lassú recruitment) ellenére megerősít abban, hogy csak extrém értékek esetén érdemes beavatkozni a vérnyomásba. Én nagyjából 140-180-nak örülnék, de ez teljesen önkényes. Ti milyen cél vérnyomást igyekeztek tartani?
https://www.ncbi.nlm.nih.gov/pubmed/30460598
0 notes
Photo

nehezen értékelhető vizsgálat a tájékozódó ultrahang hasznáról sürgősségi osztályos újraélesztésben, de mivel a POCUS forrongó téma, nehéz elmenni mellette
- a vizsgálatban, ha álló szívet láttak ultrahanggal, korábban abbahagyták az újraélesztést. Hogy ez önbeteljesítő jóslat vagy józan döntés azt egyenlőre nem tudjuk - ha ultrahanggal mozgó szívet láttak újraélesztés közben (pseudoPEA), akkor hosszabb ideig reszuszcitálták, több beavatkozást végeztek - így ROSC és kórházi felvétel is gyakrabban történt. Megintcsak kérdéses, hogy ezt az ultrahangnak köszönhetjük vagy a hosszabb újraélesztési kísérleteknek - Mindezek ellenére még ebben a válogatott csoportban (psedoPEA) sem voltak szignifikánsan többen, akik haza tudtak menni a kórházból
https://www.cureus.com/…/18740-does-point-of-care-ultrasoun…
https://www.thebottomline.org.uk/summaries/icm/shoc-ed-3/
0 notes
Photo

[HOSSZÚ] Minőségjavítás, Protokollok, Határok és Korlátok - Az EPOCH vizsgálat tanulságai
Nagy-Britannia elég nagy ahhoz, hogy nemzetközi szintű kutatás-fejlesztési ágazatot tartson életben, de elég kicsit ahhoz, hogy képes legyen nemzeti szintű programok futtatására. Ilyen programok hatására sikerült például a multirezisztens kórokozókat visszaszorítani, az MRSA arányt 10%-alá csökkenteni.
Nos ezt a sikert nem sikerült reprodukálni az akut hasi laparotómiáknál. Az EPOCH nevű vizsgálat során 93 NHS kórház 15856 betegénél lépcsőzetes cluster intervenciót alkalmatak. Ez azt jelenti, hogy egy kontroll periódust követően a kórházak egy komplex, sok elemből álló protokollt vezettek be az akut laparotómiák ellátását illetően. Ezeket alább részletesen is írom, de olyanok szerepeltek benne, mint szakorvosi döntéshozatal, időhöz kötött képalkotó, műtét és antibiotikum használat, posztoperatív ITO megfigyelés. A protokoll elemeit nem kötelezően varázsütésre kellett bevezetni, az EPOCH csapat inkább megosztotta a csomagot a kórházak kulcsembereivel és közös ötletelésre, szervezkedésre buzdította őket. A különböző intervenciók prioritásai, a bevezetés módszerei teljesen a kórházakra volt bízva. A lépcsőzetes cluster szerint 5 hetente egy új régió kórházaiban kezdődtek a változások, vagyis bizonyos régiókban a kontroll periódus volt hosszabb, míg máshol a beavatkozós időszak. A vizsgálat végrehajtásának részleteit illetően érdemes elolvasni a cikket.
Ami szerintem meglepő, hogy azt gondolnám, önmagában attól, hogy létrehozunk egy friss szellemiségű ellátási csomagot és külső támogatással kórházak lelkes emberei elkezdenek ennek mentén azon gondolkodni, hogyan is jobbíthatnák ennek a betegcsoportnak az ellátását, annak sikeresnek kell lennie. Sokkal inkább várnám ettől a sikert, mint egy új gyógyszertől vagy lélegeztetési módtól. És mégsem lett sikeres; még trendszerűen jobb számok sem születtek, sem mortalitás, sem más végpontok tekintetében.
Miért?
Szerencsére a nyers és lehangoló számokon kívül két érdekes cikk is kíséri a Lancet-ben megjelent vizsgálatot. Mindekettő melegen javasolt olvasásra a sok interjú részlet miatt. Az egyik – etnográfiai – cikkben a vizsgálatban résztvevőkkel készült interjúk tanulságait adják közre, a másikban, pedig a „process” eredményeket, vagyis hogy mi és hogyan valósult meg az eredeti beavatkozáscsomagból. Ennek a két cikknek a tartalmából szemezgetek.
Először is egy képen a care pathway, protokoll

Etnográfiai tanulságok – 53 interjú, 216 óra megfigyelés
Elfeledett probléma: A mindennapi munka alapvetően az elektív műtétek pörgetésére van kihegyezve. A sürgős laparotómiákat senki sem érezte magáénak, ahogy nincs például akut hasra specializálódott sebész vagy aneszteziológus sem. A résztvevők alapvetően pozitívnak értékelték és összekovácsolta őket, hogy a vizsgálat ráirányította a reflektorfényt erre az „elfeledett” betegcsoportra.
Protokoll vs Egyéni döntést: Az elektív munkával szemben, egy sokkolódó perforációnál jóval nagyobb az időnyomás, nagyobb a betegek és a helyzetek heterogenitása. Nem csoda, hogy itt nagyobb teret kap az egyéni döntés. Ebből egyre több probléma adódott a protokoll megvalósítását illetően. Egy sok közül: például szükség lett volna minden betegnél artériás vérgázra, de egy fiatal, jól lévő betegnél az ellátó csapat ezt sokszor nem tette meg az összességében megnyugtató klinikai képre hivatkozva. Aztán voltak reálisan nem mindenhol megvalósítható elemek is, például a magasabb rizikójú betegek (POSSUM 5%+) rutinszerű ITO felvétele. A visszajelzésekből úgy tűnik szerencsésebb volt a protokoll elemeit emlékeztetőképp használni, mint kőbe vésett mindenáron betartandó bibiaképp (ellentétben pl. a WHO csekklistával).
Kommunikáció: A sztandardizációnak azonban voltak előnyei is. Kötelezővé téve a sebészi és aneszteziológus szakorvosi döntéshozatalt közös döntésre és műtét utáni követésre buzdította a csapatot. Közös nyelvet is „kaptak”, például a POSSUM segítségével számított magas mortalitás esetén volt mivel felhívni az ITO-t, hogy miért van szüksége a betegnek ágyra. Hajnali 3-kor is.
Process eredmények – Mi történt valójában?
A konkrét program megvalósításán túl az EPOCH igazi célja a résztvevő kórházak quality improvementjének stimulálása volt, a kulcsemberek összehozásával, a problémák megbeszélésével, a minőségjavítás módszertanának oktatásával, támogatással és visszajelzéssel. Talán ez volt igazából a tesztelt beavatkozás.Az eredményekből az rajzolódik ki, hogy az elején magas lelkesedés, a meetingeken való részvétel fokozatosan csökkent. Másrészt bizonyos az intervenciós csomag elemei közül szinte mindenhol válogattak és prioritizáltak. A 37 elemes csomagból a kórházak fele kb. 11-re fókuszált.

Az eredményekből kiderül, hogy ez nem véletlen. Ilyen rövid idő alatt ennyi beavatkozást és változást létrehozni valószínűleg lehetetlen feladat. A visszajelzések alapján pozitívan értékelték és folytatnák a szisztematikus minőségjavítást, adatgyűjtést. Javítandónak gondolták kollégák és a vezetés közelebbi bevonását és a saját vezetői és projekt menedzseri képességek javítását.
Tehát mi kell (még) egy jó QI projekthez?
dedikált idő, erőforrások – a vizsgálat résztvevői nem kaptak plusz időt (és pénzt) a rengeteg extra munka elvégzésére
idő a változások létrehozására – egyszerű vagy komplex változások egyaránt sok időt igényelnek. A vizsgálat keretei során rendelkezésre állt hetek, hónapok nem voltak elegendőek egyrészt hogy a tervezett nagyszámú intervenciót bevezessék, másrészt ezek „megérjenek”, valódi változást hozzanak létre
aktív részvétel a kórházvezetés részéről – enélkül nem fog rendelkezésre állni a megfelelő mennyiségű erőforrás, például az előbb említett idő, sem nem lesz a résztvevőknek megfelelő felhatalmazása
minél szélesebb körű részvétel és minden kulcsember bevonása - ahol a csapat összetartóbb volt, jobban sikerült az intervenciók bevezetése, ahol kimaradtak kulcsemberek óhatatlanul is lassabban, kevésbé sikeresen ment a minőségjavítás
Összességében a vizsgálat lehangoló eredményét messze ellensúlyozza a kiváló megvalósítás és publikáció. Az ezekből levonható tanulságok pedig biztosan sok QI projektnek hasznára lesznek még. Jó böngészést!
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(18)32521-2/fulltext
https://onlinelibrary.wiley.com/doi/full/10.1111/1467-9566.12585
https://implementationscience.biomedcentral.com/articles/10.1186/s13012-018-0823-9
0 notes
Photo

Penicillin allergiások szisztematikus kivizsgálása során 5-ből, mindössze 1 betegnél igazolódott az allergia. Az alábbi vizsgálat alapján úgy tűnik, az allergiás státuszt egyszerű anamnézis felvétellel, esetleg orális teszttel mi is fel tudnánk mérni, hatékonyan azonosítva a valódi allergiásokat.
Noha első látásra úgy tűnhet, hogy a penicillin allergia nem probléma, csak más antibiotikumot kell használni, a sokszor drágább, mellékhatásokkal rendelkező, multirezisztens kórokozókat kiszelektáló vagy éppen kevésbé hatékony antibiotikumok (meropenem, vancomycin, gentamicin, clindamycin) nem előnyös a betegnek és jelentős terhet ró az egészségügyi rendszerre is.
Az érintett Új-Zélandi kórházban a klinikai gyógyszerészek minden újonnan felvett penicillin allergiásnak mondott betegnél részletes gyógyszeres anamnézist vettek fel, majd további tervet állítottak fel.
akiknél a beszélgetés során nyilvánvaló volt a reakció típusa, helyben hagyták azt. Ha nem azonnali hiperszenzitív reakció volt (pl. hasmenés), kitörölték a penicillin allergiát az elektronikus rendszerből, elmagyarázták a betegnek, és a háziorvosnak is írtak erről tájékoztatót, javaslatot tettek AB váltásra, ha AB-n volt.
akiknél nyilvánvalóan igen (pl. anafilaxia, Stevens-Johnson sy.), ott helyben hagyták az allergiás státuszt
akiknél az allergia késői hiperszenzitív reakciónak (pl. késői kiütés) tűnt, vagy nem volt világos a reakció (pl. nem emlékeztek rá) vagy orális tesztet javasoltak, ami placebo és egyre növekvő dózisú amoxicillint jelentett (5, 50, 500mg) vagy allergológushoz küldték (részletesebb folyamatábra a cikkben
Mit találtak?
A 2 hónapig végzett vizsgálatban 2535 beteg közül 274 tűnt penicillin allergiásnak a vizsgálat előtt (10%)
Átlag 22 éve volt az ’allergiás reakció’ és 57%-nak nem volt világos emléke erről
Akiknél törölték az allergiás státuszt gyakran számoltak be: kiütés, hányás-hányinger, szédülés, fejfájás
A valóban penicillin allergiásoknál a fulladás, légúti duzzanat dominált
199 (80%) nem volt valóban penicillin allergiás a kivizsgálást követően
20%-ot referáltak allergológiai kivizsgálásra, ezek 47%-nál igazolódott valódi penicillin allergia
14%-nál végeztek orális tesztet, ami 91%-ban negatív lett
Az egy éves követés során azt találták, hogy akiknél eltávolították a penicillin allergiás címkét - nem volt akut hiperszenzitív reakció - 3 esetben volt késői hiperszenzitív reakció (kiütés)
Az antibiotikumon lévő betegeknél AB váltást javasoltak, így ennek megfelelően az intervenciót követően többen kaptak penicillin származékot és cefalosporint.
https://academic.oup.com/jac/advance-article-abstract/doi/10.1093/jac/dky575/5307963#.XF3VSKeIfi9
0 notes
Photo



Mesterséges intelligencia szeptikus beteget kezel
- kedvcsináló a korábbi poszthoz
A Nature-ben megjelent vizsgálatban egy algoritmust igyekeztek létrehozni, mely szeptikus betegek első 72 órájában a folyadék és vazopresszor terápiát kezeli.
A legizgalmasabb maga módszer, hogy mit is értünk mesterséges intelligencia alatt, hol tart ez a terület. A MIMIC-III nyílt nemzetközi adatbázist felhasználva felosztották a betegellátás első 72 órát 4 órás blokkokra. Megerősített tanulást (reinforced learning) alkalmaztak az ideális algoritmus „kiképzésére”: az egymást követő 4 órás blokkokat vazopresszor és folyadék tekintetében döntési pontokként elemezve, a 48 betegváltozót figyelembe véve az algoritmus „piros pontokat” kapott a túlélésért és „feketét” a mortalitásért. Az így megszületett legjobb „AI dokit” aztán egy másik eRI nevű adatbázison tesztelték.
És hogyan kezelne az AI doki? Noha nyilván nem állíthatjuk, hogy ez az optimális, mégis érdekes: - korábban és több vazopresszort, valamint kevesebb folyadékot adna – ez egész véletlenül egybe vág a folyadékterápia mostani trendjével - Elemezték, hogy a humán és AI doki mely változókat használt leginkább a folyadék vs vazopresszor kérdés eldöntéséhez. Úgy tűnt az AI több változót vett figyelembe, mint emberi kollégái. Még olyan gyöngyszemeket is elcsíphetünk, hogy a folyadék adásánál az emberi orvosnál magasan szerepelt a vizeletürítés és a kreatinin, még AI társánál kevésbé, ami szintén egybevág a frissebb trendekkel.
https://www.nature.com/articles/s41591-018-0213-5
0 notes
Photo

Hogyan használjuk a diuretikumokat szívelégtelen pangó betegnél?
- Javaslat ’position statement’ az ESC szívelégtelenség részlegétől
Érdekes pontok
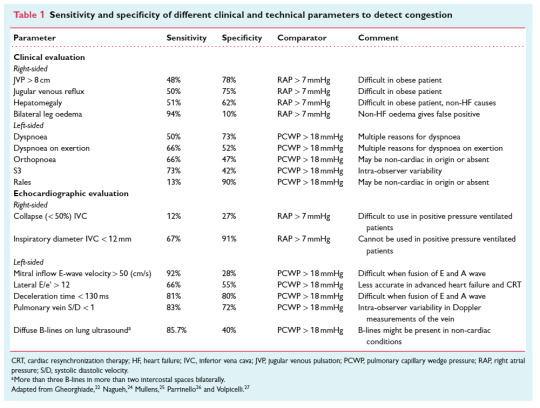
1) Mely klinikai és ultrahangos paraméterek mennyire korrelálnak a folyadék többlettel?
Részletes táblázat található szenzitivitási és specificitási értékekkel. Néhány kiemelés:
vigyázni kell az alsó végtagi ödémával. Noha szenzitív (94%), nem specifikus (10%), mivel rengeteg nem kardiális
pangásos szörtyzörejek a tüdő felett: noha 90% specifikus, alig szenzitív 10%. Nagyon szívelégtelennek kell lenni, hogy tüdőödémát tapasztaljunk.
IVC-nél kiemelve, hogy lélegeztetett betegeknél nem megbízható. Az összeesés 12% szenzitív, 27% specifikus
Hasznos ultrahangos paraméterek:
DcT < 130ms 81%, 80% szenzitív és specifikus
tüdővéna S/D < 1 83%, 72% szenzitív és specifikus
Diffúz B vonalak 85% szenzitív, de sajnos sok más oka is lehet, így 40%-ban specifikus
2) Szép táblázatok a diuretikumok farmakokinetikájáról és farmakodinámiájáról
ld. az eredetiben
3) Diuretikum rezisztencia
3/0
Szívelégtelen, pangó betegeknél már az elejétől fogva hasznos lehet MRA (pl. spironolakton) adása. Azért is fontos a korai kezdés, mert ez pro-drug, hosszú hatásbeállással. Egy friss vizsgálat alapján 25mg elégséges kezdő dózisnak tűnik ebben az esetben. A spironolaktonnál nem elsősorban a diuretikus hatást, hanem a szívelégtelenségben bizonyított jótékony hatást és a kálium vesztés mérséklését használjuk ki.
3/1 Első lépés: még több furosemid
A javaslat a furosemid dózisának eszkalálását javasolja duplázással a terápiás hatás eléréséig. Fontos, hogy nem egyszerűen szabadvizet szeretnénk eltávolítani, hanem nátriumot és vizet. A terápiás cél a javaslat szerint 100-150ml feletti óradiurézis és 50-70 mEq feletti nátriurézis.
3/2
Ha a fenti stratégia nem segít a következő lépcső a hypothiazid. A thiazidok a disztális kanyarulatos csatorna nátrium visszaszívását gátolják. Ez különösen hasznos lehet hosszú ideje diuretikumon lévő és ITO-n fekvő betegeknél, ahol a csatornák számának megnövekedése, illetve kritikus betegségben endokrin változások miatt általában só visszatartó állapotot alakul ki. Itt is fontos, hogy a időben megkezdjük az adagolást, mert a behatási idő hosszabb, mint a furosemid esetében.
3/3 segítség, így is pang még
!Ha ez sem segít a következő lépés az acetazolamid. Meglepően hangzik, de emellett több evidencia szól, mint az ismertebb thiazidok mellett. Kacs diuretikum mellé adva, hatékonyan növelték a só- és ezen keresztül a folyadék vesztést.További opcióként a diabétesz kezelésében használt, cukorvisszaszívást blokkoló SGLT2 inhibitor és amilorid merül fel.
4) És nem szívelégtelen, kritikus állapotú, ödémás betegek?
Szívelégtelenekkel szemben nálunk általában nem csak volumen vagy nyomásterhelés okozza az ödémát, hanem áteresztő kapillárisok is. Ezen kívül a különböző gyógyszerekkel bevitt sóterhelés és az endokrin változások által kiváltott sóvisszatartás gyakran vezet hipernatrémiához.
A furosemid természetesen az elsőként választandó és legjobban ismert diuretikum. De emellett gyakran a disztális kanyarulatos csatonában visszaszívott nátrium miatt, csak szabadvizet tudunk eltávolítani. Ilyenkor súlyosbodik a hipernatrémia és kezdjük a hypotón oldatok adagolását, miközben a beteg még mindig ödémás.Evidencia nélkül, csak a fenti rációra hivatkozva felmerülhet, hogy hipernatrémia és masszív ödéma esetén már korán kombináljuk hypothiaziddal (nátriurézis), spironolaktonnal (K megtartás). Eddig ezt szekvenciális nefron blokádnak hívják. További opcióként pedig ott van, az általam kevésbé ismert acetazolamid, amilorid és aminophyllin valamint az SGLT2 inhibitorok.
http://emcrit.org/pulmcrit/occult-diuretic-resistance/
https://onlinelibrary.wiley.com/doi/epdf/10.1002/ejhf.1369
0 notes
Text
SHOC-ED
Mi mással indítsuk az évet, mint egy blog ajánlással és a tájékozódó ultrahang hasznosságával?
A blog a thinkingcriticalcare.com, a POCUS-ról (Point of Care Ultrasound) szóló beszélgetés pedig a friss SHOC-ED vizsgálatból indul ki. Itt sokkos betegeket (100 alatti SBP) a betegek vagy szokás szerint látták el vagy végeztek tájékozódó ultrahang vizsgálatot. Ez a RUSH protokollhoz hasonlóan nem csak egyszerű szívultrahangot, hanem hasi és mellkasi vizsgálatot is tartalmazott. A kiábrándító eredmény, hogy nem csak mortalitás különbség nem volt, de a kezelés változóiban (pl. adott folyadék mennyisége, kiegészítő vizsgálatok száma) sem volt különbség.
A következő gondolatkísérletben helyettesítsük a Swan-Ganz katétert (PAC) ultrahangra: PAC = POCUS!
1. Egy szűk magasan képzett csoport elkezdni használni a a PAC-ot, annak lehetőségeit és határait, valamint az élettant jól ismerő csapat
2. Eredményeiket nagyközönség elé tárják, a folyamat során egyszerűsítve a használatának elveit (vö. RUSH stb… protokollok)
3. Ezen felbuzdulva rengetegen elkezdik használni
4. 2014-ben a PACMAN vizsgálat kimutatja, hogy a PAC nem javítja a betegek kimenetelét / ellátását, potenciális szövődményekkel jár
5. Szenior főorvost a háta mögött kinevetik a viziten, amikor egy komplex beteg ellátása kapcsán PAC behelyezését javasolja.
A gondolatkísérlet két fő tanulsággal szolgál:
Az első, hogy egy diagnosztikus eljárástól nem lehet RCT keretein belül mortalitás különbséget várni, amíg nem világos milyen lelet milyen kezeléssel jár. Például a colonoscopia mint szűrővizsgálatnál egyértelmű, hogy malignus polip esetén operatív megoldásra van szükség. Ehhez hasonló link pl. echokardiográfia és hemodinamikai változók esetében nincs bizonyítva. Egy IVC mérés a folyadék reszponzivitás szempontjából is megbízhatatlan, nem beszélve arról, hogy a szepszis patofiziolóiája jóval bonyolultabb, mint az az összefüggés, hogy ha van egy lokalizált tumor azt el kell távolítani, hogy megakadályozzuk a további terjedést. Amíg tehát nem tudjuk, hogy különböző ultrahang eredmények milyen hatékony terápiás következményekkel járnak, addig nem várhatjuk, hogy kevesebb beteg haljon meg.
A második tanulság, hogy az ultrahang veszélyesen egyszerűnek tűnik. Egy kezdőt is könnyen megtaníthatunk, hogy a fejet a mellkasra helyezve felismerjen egy pleurális folyadékot vagy pneumothoraxot. Egész más a helyzet egy traumás sérült vagy szeptikus sokkos beteg ellátásakor. Itt a potenciális leletek száma sokkal nagyobb, a leleteket egymással és a beteg klinikai állapotával összefüggésben lehet csak vizsgálni. Ebből a szempontból a gombamód szaporodó a vizsgálat mélységeit az egyszerűség oltárán feláldozó protokollok nem hasznosak. Például a RUSH protokoll a folyadék státuszt az IVC vizsgálatára szűkíti.
A vizsgálat tanulsága összességében nem az, hogy jobb, ha kezünkbe sem vesszük, hanem az, hogy ez is képzést, gyakorlatot és szabályozást igényel. Ez utóbbi furcsán hangozhat, de ahogy nyilvánvaló, hogy a radiológus rezidens is formális képzésben részesül, leletét gyakorlatától függő mennyiségben szenior is átnézi, valamint a lelet és a képanyag is archiválásra kerül, bekerül a zárójelentésbe, úgy ez az út előre a POCUS számára is, ha valóban segíteni szeretne a betegeinken.
https://thinkingcriticalcare.com/2018/11/11/pocus-mythology-and-hemodynamic-awesomeness-with-jon-and-korbin-foamed-foamer-foamus/
https://thinkingcriticalcare.com/
https://www.annemergmed.com/article/S0196-0644(18)30325-1/abstract
0 notes
Photo

A Brit kérdőíves vizsgálatban legalább 24 órát ITO-n tartózkodó betegeket vontak be, akiket a kiadást követő 3, 12 és 24. hónapban kérdőívekkel kerestek meg.A HADS kérdőívet használták a szorongás és depresszió vizsgálatára (8+), míg a PCL-C-t a PTSD diagnózisára.
Az első kérdőív kiküldésekor még élő 13155 betegből 4943 (38%) töltött ki legalább egy kérdőívet. A betegek átlag 63 évesek voltak, APACHE II 15 volt, átlag 3 napot feküdtek ITO-n. Keringéstámogatást 23-26% igényelt, Légzéstámogatást 55%.
Az kérdőívek alapján a résztvevők az alábbi százalékban szenvedtek pszichés zavartól:
46% szorongás
40% depresszió
22% PTSD
A résztvevők 55.2%-nak volt legalább egy problémája, 35.%-nak több, mint 1
Érdekes adalék, hogy a depresszió (de nem a PTSD és a szorongás) szignifikánsan és jelentősen magasabb mortalitással függött össze a vizsgált periódus alatt (HR 1.47 p<0.001).
A vizsgálat az eddigi legnagyobb, leginformatívabb felmérés a témában. Meg kell azonban említeni, hogy egyrészt a fentebb vázoltnál bonyolultabban zajlott a vizsgálat (mivel az ICON vizsgálat része volt, 3 fáziban, kisebb változtatásokkal készült), másrészt elég alacsony volt a válaszadók aránya. https://ccforum.biomedcentral.com/articles/10.1186/s13054-018-2223-6
0 notes
Photo

ARDS fenotípusok
Nap, mint nap látjuk, hogy minden ARDS-es beteg más és más.
Az ARMA, ALVEOLI és FACTT vizsgálatok eredményeit elemezve a betegeket két fő csoportra lehet bontani. Úgy tűnik, hogy a különbség elősorban a szisztémás gyulladásos válaszban van, a két csoportot a plazma IL-6, IL-8, TNFr1 alapján lehet legjobban megkülönböztetni (némi eltérés van a vizsgálatok között, hogy melyek a legjobbak). A jó hír, hogy van különbség a számunkra hozzáférhető klinikai paraméterekben is:
Az 1. típusot elsősorban direkt tüdőkárosodás pl. tüdőgyulladás okozza, mely sokszor fokális atelectasishoz vezet és fokozatosan súlyosbodik diffúz tüdőkárosodássá.
A 2. típust ezzel ellentétben szisztémás károsodás pl. szepszis okozza, a kórélettan elsősorban nem-kardiogén ödéma. Ezek a betegek érthető módon sokszor több szerv elégtelenek, gyakrabban igényelnek vazopresszort és a mortalitásuk is magasabb.
Amiért mindez érdekes, mert úgy tűnik a kezelésben is van relevanciája. Míg az 1. típusban (pl. pneumonia) a magas PEEP stratégia kisebb eséllyel sikeres a súlyos atelectasis kinyitásában, ezzel szemben 2. típus ödémájában hatékonyabb lehet. Hasonlóképp kézenfekvő, hogy a konzervatív (0 vagy negatív) folyadékmenedzsment is a 2. típusban fontosabb.
A fenti táblázatban szedtem össze a két típus jellemzőit, azonban fontos hangsúlyozni, hogy a két típus elsősorban biokémiai markerek alapján elkülöníthető. A táblázat a két típus legfontosabb különségeit hangsúlyozza, de adott betegnél nyilván sok a keveredés.
Még egy apróbb kitekintés: sztatinokat régóta vizsgálják sikertelenül sokféle kórképben, így ARDS-ben is. A HARP-II vizsgálatban úgy tűnt, hogy a 2. gyulladásos típusban hasznosak lehetnek, míg az 1.-ben nem. Hogy ez elegendő evidencia ez, az más kérdése, de jó példa arra, hogy miért zárul sok vizsgálat negatív eredménnyel olyan szindrómákban, mint sepsis és ARDS. Ezek heterogén szindrómák sokféle okkal és lefolyással, melyek valószínűleg egyéni kezelést igényelnek. Az fentiekben leírt eredmények pedig ehhez segíthetnek minket hozzá.
ARMA és ALVEOLI elemzés: https://www.ncbi.nlm.nih.gov/pubmed/24853585
FACTT elemzés: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5328179/
HARP-II: https://www.thelancet.com/journals/lanres/article/PIIS2213-2600(18)30177-2/fulltext
Gattinoni: https://www.atsjournals.org/doi/full/10.1164/ajrccm.158.1.9708031
Pulmccm: https://pulmccm.org/review-articles/illustrated-guide-phases-ards-implications-management/
0 notes
Photo

IDEAL-ICU
A franciák nemcsak a bor és sajt, szteroid és szepszis párosításban jeleskednek, de a korai vagy késői vesepótló kezelésben is otthon vannak.
A fő kérdés ugye, hogy elég-e megvárni amíg abszolut indikációja van a dialízisnek vagy pedig jobban járnak a betegeink, ha korábban, a súlyosabb veseelégtelenség kialakulásakor megkezdjük. A közelmúltban az AKIKI és ELAIN vizsgálatok jártak utána ennek részben ellentmondó eredményekkel: Az ELAIN-ben a nagyon korait (KDIGO 2) a koraival hasonlították össze, elsősorban posztoperatív betegek vettek részt és CVVHDF-et kaptak. Itt előnyösnek tűnt a korai. Míg az AKIKI-ben a korai (KDIGO 3) és későit hasonlították össze vegyes ITO-s beteganyagon. Itt a betegek jelentős része nem folyamatos, hanem intermittáló vesepótló kezelést kapott.
Az IDEAL-ICU tulajdonképpen megismétli a szintén francia AKIKI-t kisebb csavarokkal. A KDIGO helyett a RIFLE kritériumokat használja, nem zárja ki a krónikus veseelégteleneket (csak a rendszeresen dializáltakat) és, ami talán a legfontosabb a szeptikus sokk első 48 óráját nézi.
Azok a szeptikus sokkos betegek, akik a vazopresszor indításától számított 48 órán belül megfeleltek a RIFLE „F” kritériumoknak (kb. mint KDIGO 3) 12 órán belül megkezdték a vesepótló kezelést. Ennek a módja a korábbiakhoz képest nem volt szabályozva, így a betegek egy része intermittáló kezelést kapott.
A kontroll csoportban 48 órán belül csak abszolút indikációval kezdtek dialízist (K 6.5+, pH 7.15-, vízhajtó refrakter tüdőödéma), viszont 48 órán túl, ha még mindig fennállt a „Failure” stádium, szintén vesepótló kezelésbe kezdtek. Ez feltehetően megfelel a francia szokásoknak és valóban az időzítésre helyezi a hangsúlyt, ám úgy felhígíthatja az esetleges terápiás hatást, hogy mortalitás különbségre aligha számíthattak.
Az intervenciós csoportban, ahogy várható volt szinte mindenki kapott kezelést (97%), a kontroll csoportban 29%-nak egyáltalán nem volt szüksége rá, 17%-nak volt szüksége abszolút indikáció miatt kezelésre és 44% kapott dialízist a 48 óra után. Vesepótló kezelésre az intervenciós csoportban medián 4 (2-8), míg a kontroll csoportban 2 (0-6) napig volt szükség p<0.001.
Mortalitás különbség valóban nem lett, már az interim analízisnél abba is hagyták a vizsálatot, a tervezett 864 helyett csak 488-beteget vizsgálva. Így a 90 napos mortalitás 58% (korai) vs 54% (késői) lett p0.38.
Nem volt különbség vazopresszor igényben, a SOFA score alakulásában, de még a kumulatív folyadékegyenlegben sem. Hasonlóan nem volt különbség a 28 és 90 napos RRT igényben és az ITO és kórházból való kiadáskori kreatininben sem.
A vizsgálat minden hibájával együtt megerősíti, hogy szeptikus sokkos betegeknél sem szükséges sietni a vesepótló kezelés megkezdésével. A magam részéről ezek a vizsgálatok szerintem már a tervezésnél elbuknak. Nehéz elképzelni számomra, hogy valaki jelentősen jobban jár azzal, hogy a keringése egy részét kivezetjük egy mesterséges gépbe, még akkor is, ha így valamivel kevesebb kreatinin és urea marad a szervezetében, valamint az ionháztartása is rendezettebb lesz. A korai kezelés hasznát legfeljebb úgy tudnám elképzelni, ha valamit csinálnánk is a vesepótlással a szűrésen túl, például folyadékot távolítanánk el (a folyadékegyenlegek mindhárom vizsgálatban kiegyenlítettek voltak a csoportok között). Esetleg súlyosabb állapotú (ELAIN-ben volt a legmagasabb és ott előnyösebbnek is tűnt) betegeken azt próbálhatnánk meg, hogy, amint lehet folyadékot távolítunk el. Így is legfeljebb rövidebb lélegeztetésre, ITO tartózkodásra lehet legfeljebb számítani, mortalitás különbségen csodálkoznék.
Addig is, maradnak az abszolut indikációk.
https://www.thebottomline.org.uk/summaries/icm/ideal-icu/
https://www.nejm.org/doi/full/10.1056/NEJMoa1803213
0 notes
Photo

Érdemes elolvasni a forrásokat a részletek, evidencia miatt. Több helyen intervallumot adnak meg, pl. 8-9, 7-9, 7-10 tünetektől függően. Az evidenciát illetően pedig a szepszist leszámítva elég alacsony minőségű mindenhol. Mindenesetre érdemes tudni, hogy a 10-es trigger már sehol - ACS-ben sem él!
https://onlinelibrary.wiley.com/doi/full/10.1111/bjh.12143
http://annals.org/aim/fullarticle/1206681/red-blood-cell-transfusion-clinical-practice-guideline-from-aabb
https://www.blood.gov.au/pbm-module-4
1 note
·
View note
Photo

https://www.nejm.org/doi/10.1056/NEJMoa1714919
0 notes
Text
ANDROMEDA shock
Szintén a LIVES2018-on publikált Dél-Amerikai vizsgálat újszerű és egyszerű szepszis reszuszcitációs protokolljával tűnik ki. Szeptikus sokkos betegeket vontak be 8 órán belül (laktát 2+, hipotenzió 20ml/kg folyadék ellenére). A vizsgálat a randomizációt követően mindössze 8 óráig tartott. Már a vizsgálat protokollja érdekes:
Mindkét csoportban 4 dolgot vizsgáltak:
(némileg leegyszerűsítve)
1. Van-e hipoperfúzió?
Ezt a laktát csoportban 2 feletti laktát vagy 2 óra alatt kevesebb, mint 20%-os csökkenés jelezte.A perfiériás perfúzió (PP) csoportban sztandardizált kapilláris refill idő vizsgálata (3s+) jelezte. Ez utóbbit sztandardizálták.
2. Van-e folyadék reszponzivitás?
Ha hipoperfúziót tapasztaltak, a következő a folyadék reszponzivitása vizsgálata volt sztandardizált módon passzív lábemeléssel, végkilégzési okklúzióval, PPV vagy VVS-el nézték. Hogy melyiket mikor, erre részletes protokoll volt. Ha folyadék reszponzív volt a beteg, akkor 500ml folyadék bolust kapott, és vizsgálták, hogy javul-e a hipoperfúzió.
3. Vazopresszor teszt
Ha nem volt folyadékreszponzív a beteg, de volt ismert magasvérnyomás betegsége, akkor megemelték a MAP-ot 80-85-re. Ha ez segített a laktáton vagy perifériás perfúzión, maradt ez a vérnyomás. Ha nem segített vagy mellékhatást tapasztaltak, visszacsökkentették a noradrenalin dózisát.
4. Inodilátor teszt
Ha a beteg folyadékra és vazopresszorra sem reagált, akkor intrópot (dobutamin vagy milrinon) próbáltak meg és vizsgálták, hogy így javul-e laktát/perfúzió.
Néhány érdekes eredmény
Folyadék reszponzivitás: 82%-nál lehetett megállapítani, 57% volt reszponzív, 25% nem reszponzív
Vazopresszor reszponzivitás: többször volt rá szükség a laktát csoportban (40.1% vs 28.8%) 38-44%-ban használt a vazopresszor
Inodilátor teszt: 13% kapott, nem volt különbség
Kevesebb folyadékot kaptak a perifériás perfúzió csoportban 2.3l vs 2.7l p0.01. Ráadásul úgy, hogy ők a randomizáció előtt is kevesebbet kaptak (25 vs 30 ml/kg).
Az alcsoport analízisből az derül ki, hogy a kevésbé súlyos betegek (SOFA, laktát, APACHE II alapján) jártak igazán jól a perifériás perfúziós protokollal.
Végül, a 424 betegnél ilyen rövid protokollnál érthető módon nem volt szignifikáns különbség a mortalitásban (34.9 vs 43.4% p0.07 – trendszerűen jobb a perifériás perfúziós csoport), de ha lett volna is nehezen lenne hihető. Trendszerűen jobban jártak a perifériás perfúziós csoportban másodlagos végpontokban (lélegeztetés, vazopresszor, RRT mentes napok száma).
Miért érdekes ez a vizsgálat?
Közepesen tehetős országokban, egyszerű, könnyen elérhető végpontot vizsgált, mint laktát és kapilláris telődés. Bár komplex hemodinamikai monitorozás elérhető itthon a legtöbb helyen, nem ritka – különösen a kezelés elején – hogy inkább klinikai paraméterek szerint folyik a reszuszcitáció. A vizsgálat a laktát szintjére (vagy felé) emeli a kapilláris keringés vizsgálatát.
Az általam látott hazai gyakorlathoz képest kevés folyadékot adtak (24 órás egyenleg 2-2.3l), a perifériás perfúzió célzása tulajdonképpen abban segített, hogy még kevesebb folyadékot adjanak. Hasonlóképp érdekes, hogy milyen sok esetben használt a vazopreszor teszt is. Egyre többet tudunk arról, hogy a folyadék nem használ/káros így a korai vazopresszor felé tolódik el a modern ellátás. Ez a vizsgálat is efelé mozdít.
Az eredmények a LIVES2018-on kerültek bemutatásra. Érdekes lenne többet tudni a folyadék/vazopresszor/inodilátor tesztek eredményéről. Ezek csak a hivatalos publikáció után lesznek elérhetőek.
http://services.y-congress.com/congress/medias/2018/esicm2018/2840/video/y_1080p_4000kb.mp4
0 notes
Photo

Önmagában a folyadék terápiánkkal több nátriumot viszünk be, mint a javasolt napi 100 mmol.
https://www.ncbi.nlm.nih.gov/pubmed/24289511
0 notes
Photo

Prognosztikáció traumás agykárosodásban
A poszt írásakor 82-en gondoltuk, hogy az előző posztban szereplő beteg súlyos neurológiai károsodást szenbedett, míg 67 szerint valószínűbb a jó kimenetel.
A kanadai kollégák is hasonlóképpen megosztottak voltak. 27% gondolt rossz prognózisra, 41% jóra, míg 32% nem kötelezte el magát (nem egészen értem, miért volt ilyen lehetőség). Ami még érdekes, 10% a rossz prognózis miatt, ha a család teljes egyetértése is adott, kezelés visszavonását is elfogadhatónak tartotta. („comfortable with the decision to withdraw life-sustaining therapies”).
Sajnos a példában szereplő esetre megoldás nincs, teljesen fiktív volt, sajnos azonban a valóságban is hasonlóan nehéz a helyzet. A vizsgálat rávilágít, mennyire nehéz a korai – értsd intenzív osztályos - prognosztikáció TBI-ban. A példa szcenárióban gyakorlatilag a GCS, némi klinikai infó és a CT kép alapján kellett dönteni. Lássuk mit lehet tudni ezekről részleteiben:
(A következőben a Brain Trauma Foundation összefoglalóját dolgozom fel. Link alább.)
GCS
A beteg neurológiája magától értetődően első helyet kap a prognosztikációban. A GCS-el azonban vannak problémák
első észlelés GCS sokszor nem pontos vagy nem is elérhető
különböző vizsgálók eltérő eredményre jutnak
A tudatállapot romlására érzékenyebb (pl. GCS csökken, kontroll CT szükséges, rávérzés), mint a tudat javulására. Az akut szakaszon túljutottak, pl. vegetatív állapotban lévőknél egyáltalán nem jelzi a fokozatos apró javulást.
Ezek miatt több módosítása, alternatívája akadt. Az akut szakaszban az egyszerűbb AVPU, a bonyolultabb, agytörzsi reflexek is vizsgáló, pontosabb FOUR a kihívója. A krónikus szakban pl. a WHIM (Wessex head injury matrix).
Mindezek mellett egy olyan régóta használt, mindenki számára ismert közös nevezőt, mint a GCS nehéz lesz kimozdítani a helyéről. Noha a GCS önmagában nem megbízható prognosztikációra, azért érdemes lehet átnézni az alábbi táblázatot, hogy adott GCS milyen mortalitással függ össze, illetve milyen eséllyel jár jó kimenetellel. A táblázat a GCS-P-t használja. Egyszerűen a GCS-ből ki kell vonni areaktív pupillánként egyet. Tehát GCS 3 és egyik pupilla sem reagál az GCS-P 1.

Életkor
Az életkor, bár nem feltétlenül kellene, hogy számítson, azonban mind a regenerációs képesség, a sérülések mintázata és a szisztémás komplikációk esélye miatt igen fontos prognosztikációs faktor. Az alább linkelt összefoglalásban, több vizsgálatot idézve annyit állapítanak meg, hogy 60 év felett szignifikánsan nő a rossz kimenetel esélye.
Hipotenzió, Hipoxia
A hipotenzió és hipoxia tipikusan a balesettől az intenzív osztály vezető úton történik, legyen az oka hosszú kimentés, nehéz légútbiztosítás vagy masszív vérzés. Ebben az időszakban az agy különösen sérülékeny a szekunder károsodásra, hiszen nincs neuromonitorozás és az esetleges idegsebészeti beavatkozás sem történt még meg. Az ezzel foglalkozó vizsgálatok kritikájaként hozzá kell tenni, hogy érthető okokból nem RCT, inkább obszervációs vizsgálatokról beszélünk és könnyű elképzelni, hogy a hipotenzív betegek súlyosabb traumán estek át, súlyosabb állapotban voltak, ami befolyásolja ennek a két változónak tulajdonított jelentőséget. Ezekből a vizsgálatokból mindenesetre úgy tűnik egyetlen mért 90 alatti szisztolés vérnyomás kétszeres mortalitással járhat. Hosszabb korai hipotenziós epizód esetén 15-szörös a szorzó.
CT kép
Egyéb tényezők, melyek rosszabb prognózissal függenek össze
bármilyen eltérés szemben a felvételkor normális CT képpel. Érthető módon, ha nincs kezdeti eltérés, akkor jobb a prognózis. Egyébként a felvételi CT csak az esetek kb. 10%-ban normális és itt is 40%-ban megjelenik később valamilyen eltérés.
Összenyomott bazális ciszternák. Érthető módon specifikus, de nem szenzitív. Megléte esetén 2-3-szoros a mortalitás.
Traumás subarachnoideális vérzés. Itt a vérzés vastagság a fontos. Az aneurizmás vérzéssel szemben általában nagyobb a subarachnoideális vérmennyiség. 5mm felett számít igazán súlyosnak, különösen, ha kamrákat is érint vagy subdurális vérzéssel függ össze. Kétszeres mortalitás növekedésről beszélnek.
Középvonali áttolás. Szintén 5mm számít jelentősnek.
Ha van haematóma, annak típusa. Az epidurális hematómák gyógyhajlama a legjobb, ennél lényegesebn rosszabb a subdurális vérzések prognózisa. A diffúz károsodás képe a kettő között áll. Részletesen lásd az alábbi táblázatban.
A CT képnek többféle osztályozása ismert, alábbi az egyik népszerű TCDB (Traumatic Coma Data Bank)

Végül érdemes megjegyezni, hogy két „kalkulátor” is rendelkezésünkre áll a prognosztikációkor. Ezek nagy multinacionális adatbázisok alapján létrehozott és validált modellek, melyek szabadon használhatóak. Ezekről pár szóban:
IMPACT
http://www.tbi-impact.org/?p=impact/calc
Amerikai központú (National Institute of Neurological Disorders and Stroke) adatbázis jelenleg 9099 beteget számlál. Nemzetközi vizsgálatok adatait gyűjti egy helyen és mér ez alapján. A következő változókat használja: GCS, pupilla, életkor, CT kép, többféle szekunder változó (hipoxia, hipotenzió, vércukor, hb). 2008-as publikáció.
CRASH
http://crash2.lshtm.ac.uk/Risk%20calculator/index.html
Az angol Medical Research Council kezdeményezte nemzetközi adatgyűjtés eredménye a 10008 beteg. Nem más vizsgálatokat dolgoz fel és jelentős számban képviseltetik magukat benne szegényebb országok is. A modell hasonló dolgokat néz, az egyetlen különbség, hogy szekunder károsodás helyett szegényebb vagy gazdagabb ország számít. 2007-es.
Mindkét kalkulátor mortalitást és hosszú távú neurológiai kimenetelt is tippel. Nyilván életvégi döntés meghozatalára önmagában nem használhatóak, de integrálják a fenti változókat és segíthetik a hozzátartozókkal való kommunikációt.
Összefoglalásképp
A traumás agykárosodás korai – intenzív osztályos - pontos prognosztikációja a szürke zónában nem lehetséges. Fontos, hogy a negatív prognosztikációkor tudatában legyünk, hogy a mi nézőpontunkat negatívan befolyásolja, hogy betegeinket a legsúlyosabb állapotukban látjuk és kevés a későbbi visszajelzés, pedig rengetegen gyógyulnak meg. A legtöbb esetben elengedhetetlen a család bevonása, hogy betegünket és értékeit jobban megismerjük, hogy a lehető legjobb döntést tudjuk hozni.
Linkek
https://braintrauma.org/uploads/01/03/prognosis_guidelines.pdf
https://www.ncbi.nlm.nih.gov/pubmed/23385104
1 note
·
View note
