LV Laboratorios Clínicos somos una empresa con más de 40 años de experiencia cuya actividad más importante es realizar estudios de laboratorio clínico necesarios para conservar la salud de sus pacientes y abarcamos los campos de prevención, diagnóstico...
Don't wanna be here? Send us removal request.
Text
LA PRUEBA DE COOMBS Y SU IMPORTANCIA CLÍNICA.
BQD. Diana Mariel Méndez Fernández Bioquímica Analista.
QFB. Francisco Bravo Alemán Jefe de LV Laboratorios.
Te has preguntado porque podemos tener diferente grupo sanguíneo dentro de una misma familia.
En LV Laboratorios clínicos estamos convencidos de que un Laboratorio que se actualiza, debe repasar los acontecimientos históricos importantes;para seguir creciendo y para responder a los nuevos estándares de calidad que hoy día demanda el cuidado de su Salud.
Es por eso, que hemos querido hacer un breve repaso en la memoria de los pioneros, los investigadores que dedicaron su vida al estudio de los grupos sanguíneos y en particular a Robert Royston Amos “Robin” Coombs, nacido en Londres el año de 1921 y a quien debemos hasta el día de hoy, que muchas vidas se conserven, ya que gracias a sus aportaciones las Transfusiones son procedimientos con un alto grado de seguridad.
Comencemos en explicar que es un grupo sanguíneo, es una forma de agrupar ciertas características que presenta la sangre en base a la presencia o ausencia de determinados antígenos (Ag), siendo estos un tipo de proteínas, las cuales se encuentran en la superficie de la membrana de los glóbulos rojos, estos Ag son determinados genéticamente durante el embarazo.
Este hecho histórico sobre los grupos sanguíneos ( A, B, O) se le atribuye a Karl Landsteiner, en 1909, su investigación se basaba en comparar la genética de la sangre humana con la de los monos, un dia descubrio que al mezclar la sangre de algunas personas los glóbulos rojos se aglutinan (formando cúmulos o conglomerados), formando una especie de conglomerados.
Otras investigaciones de Landsteiner y Levine en 1927, ya habían reportado los grupos sanguíneos M, N y P; era muy curioso, porque no pasaba del mismo modo con todas las muestras de sangre, sino que presentaba variaciones. Para comprobar por qué ocurría este fenómeno, decidió seguir recolectando muestras, incluyendo su sangre y la de algunos de sus compañeros de la Universidad, las procesó del mismo modo, separando el suero de los glóbulos rojos y después mezclandolos de tal forma que le dieran todas las combinaciones posibles.
De ese modo pudo concluir que había tres tipos de sangre, a los que llamó A, B y O, cerrando la lista un año después con la observación del grupo AB.

Grupo sanguíneo A: Tiene Ag “A” en la superficie de sus glóbulos rojos y Ac contra los Ag “B” en el suero de su sangre.
Grupo sanguíneo B: Tienen Ag “B” en la superficie de sus glóbulos rojos y Ac contra los antígenos “A” en el suero de su sangre.
Grupo sanguíneo AB: Poseen ambos antígenos en sus glóbulos rojos y ningún anticuerpo en su suero. Las personas del grupo O no tienen antígenos en la superficie de sus glóbulos rojos y ambos anticuerpos en su suero
SISTEMA RH
Más adelante en 1939 Levine & Stetson publicaron su artículo clásico de 2 hojas donde describen la Enfermedad Hemolítica del R.N. (EHRN); al año siguiente en 1940, Karl Landsteiner junto con Alexander Solomon Wiener detectaron la existencia de un nuevo antígeno (proteína) en la membrana de los glóbulos rojos en la mayoría de la población.
Este antígeno es llamado Rh, ya que las primeras investigaciones se llevaron a cabo experimentando con un simio del tipo Macaccus Rhesus. Este descubrimiento fue muy importante, ya que gracias a él, las transfusiones de sangre podían hacerse con conocimiento, evitando rechazos derivados de la incompatibilidad de los grupos sanguíneos.
Por eso, en 1930, incluso antes del descubrimiento del Rh, se le otorgó a Karl Landsteiner el premio Nobel de Medicina, como reconocimiento a una vida entregada a la ciencia y a la salud de las personas.
De la misma manera que en el sistema ABO, en el sistema Rh no se puede transfundir el antígeno Rh a las personas que no lo tienen, ya que podría originar la producción de anticuerpos Rh en el receptor. Los sujetos Rh negativos sólo podrán recibir sangre de donantes Rh negativos. Este sistema explica la enfermedad hemolítica (o eritroblastosis fetal) del recién nacido. Esta enfermedad, de aparición en el segundo hijo, podía incluso llegar a provocar la muerte de éste. Investigaciones ´posteriores comprobaron que el antígeno del mono Rhesus lo poseen la mayoría de los humanos. A sugerencia de Levine, se conservó la denominación de factor Rh para el antígeno humano y LW para el antígeno común al hombre y al mono.
Pero su aportación a la ciencia no terminó ahí, ya que en 1940 también descubrió el antígeno Rh, que puede ser positivo (Rh+) o negativo (Rh-). La importancia de los grupos sanguíneos fue reconocida hasta 1945 cuando Coombs, Mourant y Race publicaron sus observaciones en Lancet y el British Journal of Experimental Pathology sobre el uso de Anticuerpos de conejo contra la IgG humana (Anti Gamma Globulina Humana) para detectar eritrocitos “sensibilizados” o recubiertos con IgG. La prueba de Coombs o “prueba de Antiglobulina Humana” se convirtió en la “prueba de oro” en todos los servicios de Transfusión Sanguínea, previniendo muchas de las incompatibilidades que se presentaban.
Para entender mejor en qué consiste la prueba de Coombs se definirán a detalle dos términos importantes que se estarán mencionando durante el resumen.
· Un antígeno (Ag) es cualquier sustancia que, cuando ingresa al organismo y se reconoce como extraña, provoca una respuesta inmune. Ésta podría inducir la producción de anticuerpos específicos que determinan una reacción observable.
· Los anticuerpos (Ac) son proteínas producidas por el sistema inmune cuando se detecta un agente como ajeno y/o extraño poniendo en riesgo la salud y debe ser destruido por los inmunocitos. Si la detección del sistema inmune es errónea, produce anticuerpos que atacan al propio sistema y los considera como amenaza.
PRUEBA DE COOMBS
Existen dos análisis de sangre que pueden comprobar si hay anticuerpos que ataquen a los glóbulos rojo la prueba de Coombs directa y la prueba de Coombs indirecta, cada uno con un fin diagnóstico diferente al igual que su metodología.
¿CUANDO SE REALIZA UNA PRUEBA DE COOMBS ?
Durante el embarazo, la madre y el bebé pueden tener grupos sanguíneos diferentes y convivir sin problema; esto se debe a que la sangre de ambos en realidad no se mezcla, sino que sólo intercambian nutrientes y productos de desecho en la placenta a través de una membrana. Sin embargo, durante el parto la placenta se rompe, y a través del canal del parto la sangre del bebé y la madre se mezclan; en ese momento no tiene mayor importancia, pero, si la madre es Rh negativo y el bebé Rh positivo, la madre formará anticuerpos defensivos contra los eritrocitos de su bebe (sangre Rh positivo), que pueden atravesar la placenta en un próximo embarazo y dañar al siguiente feto si este Rh positivo. Esto podría suceder a partir del segundo embarazo.
El test de Coombs pretende detectar si las madres que son Rh negativo tienen o no anticuerpos contra la sangre Rh positivo. Se realiza de forma sencilla extrayendo sangre de la madre y añadiendo sustancias sintéticas que simulan al factor Rh positivo. Hay dos tipos de test de Coombs:
Coomb directo.
La prueba de Coombs directa también se utiliza para diagnosticar EHRN (enfermedad hemolítica del recién nacido) debida a incompatibilidad sanguíneo materno-fetal. En el momento del nacimiento la madre puede haber quedado expuesta a antígenos de los hematíes del bebé y puede haber generado anticuerpos contra los hematíes de su hijo. Este sería el caso de un bebé Rh-positivo cuya madre es Rh-negativo. Anteriormente, la presencia de anticuerpos frente al antígeno Rh constituía la causa más frecuente de enfermedad hemolítica del recién nacido, si bien actualmente esta situación es rara gracias al uso de tratamientos preventivos administrados a la madre durante y después de cada embarazo. La causa más frecuente de enfermedad hemolítica del recién nacido en la actualidad es la incompatibilidad ABO entre una madre del grupo O y su bebé. Este tipo de incompatibilidad materno-fetal suele ser leve.
La prueba de Coombs directa también puede utilizarse para evaluar una posible reacción transfusional. Si después de haber recibido una transfusión de sangre se presenta fiebre u otros síntomas sugestivos de una reacción hemolítica transfusional, la prueba de Coombs directa indicará si la persona ha generado anticuerpos contra los hematíes transfundidos. Si se detecta anticuerpos fijados a la superficie de los hematíes, éstos pueden ser destruidos (hemolizados) o eliminados de la circulación antes de lo normal.
Cuando se sospecha de una posible Eritroblastosis fetal o enfermedad hemolítica del recién nacido, esta surge por la incompatibilidad sanguíneo materno-fetal ya que la madre y el bebé tienen grupos sanguíneos diferentes, la madre produce sustancias llamadas anticuerpos (Ac) que atacan los glóbulos rojos del bebé en desarrollo, ocasionando anemia o ictericia neonatal, significa que el bebé tiene un alto nivel de bilirrubina en la sangre provocando que la piel luzca amarillenta. Otro ejemplo, es la anemia hemolítica autoinmune, esta es una enfermedad poco frecuente, induce la formación de anticuerpos (Ac) contra los propios glóbulos rojos de una persona.
Técnica del Coomb Directo (CD).
1.- Se lavan los eritrocitos del paciente con solución salina isotónica. se centrifugan y se decanta el sobrenadante para eliminar sustancias que pudieran interferir.
2.- Se realiza una suspensión de Hematíes al 2-5 % en solución salina isotónica.
3.- Se toman 2 gotas de la suspensión anterior y se les añade 2 gotas del Suero de Coombs.
4.- Se incuba a 37o C durante 20 minutos.
5.- Agitar suavemente para deshacer el botón. La lectura puede hacerse de forma directa en el tubo o por observación al microscopio.
La formación del aglutinado corresponde a un resultado positivo (+), significa que los eritrocitos del bebé (de un segundo embarazo) se encuentran sensibilizados, esto quiere decir que, los eritrocitos han reconocido a los anticuerpos anti-D, (Factor Rh) producidos por la madre, generando una reacción Ag-Ac y la adición del suero de Coombs ayudará a favorecer la formación del aglutinado. El “Suero de Coombs” contiene anticuerpos (Ac), su objetivo es producir la formación de un aglutinado (malla visible a simple vista) esto se debe a que los anticuerpos presentes en el suero de Coombs van a unirse con los anticuerpos que ya se encontraban unidos al antígeno ubicado en la superficie de los glóbulos rojos, causando aglutinación de las células.

Una prueba de Coombs directa positiva debido a una infección, a una reacción transfusional o a fármacos puede persistir positiva entre 48 horas y hasta unos 3 meses. En caso de que se trate de un trastorno autoinmune, la positividad se mantendrá seguramente durante toda la vida.
COOMBS INDIRECTO o “CRUZADO” .
¿Cómo se utiliza?
La prueba de Coombs indirecta se utiliza para detectar anticuerpos dirigidos contra antígenos de hematíes, distintos de los antígenos ABO. Se realiza siempre que se prevé una transfusión de sangre. Si se detecta algún anticuerpo, debe procederse a una prueba de identificación de anticuerpos para conocer cual de ellos está presente. Al verificar la compatibilidad entre donante y receptor, y en el caso de que se detecten anticuerpos, se realiza una prueba de Coombs indirecta modificada. Es importante que la sangre del donante no contenga los antígenos frente a los cuales el receptor presenta ya anticuerpos.
Si alguien presenta una reacción transfusional (inmediata o tardía), el médico solicitará las dos pruebas de Coombs (directa e indirecta) para investigar la causa de la reacción. Una vez se haya resuelto la situación, puede solicitarse nuevamente la prueba indirecta para saber si el paciente ha desarrollado más anticuerpos.
Durante el embarazo la prueba de Coombs indirecta se utiliza para detectar anticuerpos que podrían atravesar la placenta y atacar las células del feto, causando la EHRN. Revisten especial importancia unos anticuerpos de un sistema de grupos sanguíneos conocido como sistema Rh. Una madre Rh negativa puede desarrollar estos anticuerpos si resulta expuesta a hematíes de un bebé Rh-positivo. Como prevención, se realiza a todas las madres Rh-negativo una prueba de Coombs indirecta durante el embarazo (a las 28 semanas) y nuevamente en el momento del parto. Si no se detecta anticuerpos Rh a las 28 semanas, se administra a la embarazada una inyección de inmunoglobulina de tipo Rh (Ig-Rh) con la finalidad de eliminar de su circulación cualquier rastro de hematíes fetales Rh positivos, así se previene el desarrollo de anticuerpos de tipo Rh por parte de la madre.
Si alguien presenta una reacción transfusional (inmediata o tardía), el médico solicitará las dos pruebas de Coombs (directa e indirecta) para investigar la causa de la reacción. Una vez se haya resuelto la situación, puede solicitarse nuevamente la prueba indirecta para saber si el paciente ha desarrollado más anticuerpos.
Técnica de Coombs indirecto y cruzado
1.- Centrifugue la muestra de sangre 10 min a 2 000 rpm para obtener el suero y decántalo en un tubo debidamente identificado.
2.- Prepare una suspensión al 2-5 % con la mezcla de hematíes “O” ( en el caso del Coombs cruzado utilice una muestra de la sangre a transfundir para preparar la suspensión).
3.- En un tubo debidamente rotulado añada dos gotas del suero y dos gotas de la suspensión y mezcle bien.
4.- Incubar ambos tubos en un Baño de María a 37ºC por 30 minutos
5.- Lave tres veces con solución salina escurriendo totalmente el sobrenadante del último lavado.
6.- Añada dos gotas de suero de Coombs poliespecífico a cada tubo.
7.- Lea desprendiendo suavemente el botón en la lámpara .
A diferencia de la prueba directa, en la prueba indirecta, busca la presencia de "anticuerpos" en el suero del paciente y no "anticuerpos" adheridos a la superficie de los glóbulos rojos. La prueba indirecta se utiliza para realizar "tipificación" de grupos sanguíneos, pruebas de compatibilidad y como método de rastreo para evitar reacciones transfusionales.
Esta prueba es muy demandada por los ginecólogos, en especial para aquellas pacientes embarazadas, tanto aquellas que sean Rh positivo como las de Rh negativas.
A diferencia de la prueba de Coombs directa, la prueba indirecta se basa en la "incubación" del suero del paciente (Rh negativo) con una muestra de sangre tipo “O” ( sensibilización in vitro) y posteriormente se procede a administrar el "suero de coombs".

La formación de la aglutinación será considerado como una prueba positiva, indica la que las células se han recubierto por anticuerpos (Ac) presentes en el suero del paciente, estos pueden ser (Ac) contra Rh positivo que estén circulando en el plasma sanguíneo de la madre Rh negativo o visceversa
Una de las causas por las que se presenta es por un embarazo previo con un bebé Rh positivo, o por un contacto con sangre Rh positivo por otros motivos (heridas, transfusiones sanguíneas, etc.)
COOMBS DIRECTO
Enfermedad hemolítica del recién nacido
Anemia hemolítica por autoanticuerpos
Anemia hemolítica debido a fármacos
Investigación de reacciones transfusionales
COOMBS INDIRECTO
Investigación de anticuerpos
Pruebas cruzadas
Fenotipos eritrocitarios
INMUNOGLOBULINA Rho (D). De acuerdo a la Secretaria de Salud en su boletín informativo indica que las futuras mamás deben ser tratadas por la inmunoglobulina Rho (D) el cual es un medicamento administrado mediante una inyección intramuscular. A menudo es conocida por uno de sus nombres comerciales, “RhoGAM”
Se le ha realizado innumerables estudios farmacológicos para evaluar su eficiencia y calidad, por lo que es sumamente segura ya que no ocasiona efectos adversos, tal vez sólo efectos locales, tales como dolor o incomodidad.
En algunas ocasiones las mamas presentan efectos secundarios por el medicamento, ya que cada organismo es diferente puede que se presente dolor de cabeza, cansancio o mareos y náuseas o vómitos
Es importante la aplicación oportuna de una inyección de inmunoglobulina Rho (D). Su primera inyección debe ocurrir durante el embarazo aproximadamente en la (2-4 semana), antes de que el cuerpo de la madre comience a producir (Ac).
Después de que nazca el bebé, se necesitará una segunda inyección si su bebé resulta tener sangre con Rh positivo. Recibir una inyección en el momento correcto durante o después de un embarazo puede disminuir el riesgo de enfermedad hemolítica para este embarazo o cualquier embarazo futuro. Esta gammaglobulina hace que la madre no forme anticuerpos anti-Rh positivo y que un próximo embarazo de un bebé Rh positivo carezca de riesgo.
Este medicamento contiene Rh, este es un antígeno que la mayoría de las personas tienen en la sangre (Rh positivo), pero otras no, como los (Rh negativo). Una persona Rh negativo puede estar expuesta a sangre que es Rh positiva durante una transfusión sanguínea no compatible o durante un embarazo si el bebé tiene el tipo de sangre opuesto. Cuando esta exposición sucede, la sangre Rh negativo responde produciendo anticuerpos que destruyen las células sanguíneas Rh positivo. Esto puede causar problemas médicos como anemia (pérdida de glóbulos rojos sanguíneos), fallo renal.
REFERENCIAS
Fainboim. Leonardo. (2011). Introduccion a la Inmunologia Humana, México. Editorial Panamericana
Coombs R.R.M.; Mourant A.E and Race R.R.- Lancet ii: 15; 1945.
Usefulness of direct test in neonatal screeneng. The International Congress of Pediatrics; Atenas, Grecia. Agosto de 2007. Baptista-González H.; Hernández-Martínez J.A.; Galindo-Delgado Patricia.Hematología Perinatal, Instituto Nacional de Perinatología, Secretaría de Salud.
Omeñaca-Teres F.; De La Cámara-Mendizabal C.; Valverde-Nuñez E.2008. Enfermedad Hemolítica del Recién Nacido. Asociación Española de Pediatría.
4 notes
·
View notes
Text
La Química Sanguínea y su importancia en la prevención de enfermedades

Elaborado por:
Q.F.B. Magaly Alcocer Medina
Química Analista de LV Laboratorios Clínicos
En nuestro país, existen aproximadamente 120 millones de habitantes y lamentablemente somos uno de los primeros países en la lista de prevalencia en diabetes mellitus, sobrepeso y obesidad en adultos y niños. La cantidad de dinero que se invierte en sector salud por estas enfermedades ha aumentado de 2000 al 2013 (OMS).
La secretaría de salud, en conjunto con la Organización Mundial de la Salud (OMS) han puesto en marcha proyectos e iniciativas para reducir estos números que son realmente alarmantes. Por otro lado, el INEGI proporciona las estadísticas de causa de muerte por enfermedades en México, siendo la primera las enfermedades del corazón, en el número dos se encuentra la Diabetes Mellitus, seguida de enfermedades cancerígenas y hepáticas (INEGI 2015). Existen formas de prevenir estas enfermedades y una de ellas es el chequeo semestral o anual (y si se requiriera un lapso de tiempo más corto) de nuestra sangre.
La sangre, es un componente del cuerpo muy importante. Lleva a cabo varias funciones imprescindibles por lo que, así como el tejido óseo (huesos) y el sistema neuronal, es clasificado como tejido conectivo. En ella se transportan muchos componentes importantes para nuestros órganos, por ejemplo: oxígeno. Pero realmente, la sangre no sólo lleva oxígeno a todo nuestro cuerpo sino también nuestra mayor fuente de energía “la glucosa” conocido como “el azúcar”, además de muchas hormonas que regulan muchas funciones, y nutrientes que sirven para crecimiento y metabolismo general de las personas.
Desde hace cientos de años los estudiosos siempre han buscado el porqué de los procesos y funciones del cuerpo. Galeno hace la primera definición de lo que sucede en el cuerpo humano, él, tomando como referencia a Aristóteles e Hipócrates habla de los “humores”, y clasifica a la sangre como uno de los cuatro humores que existen en el cuerpo.
Galeno explicaba que en el cuerpo y en todo ser vivo existían cuatro humores que controlaban su naturaleza. El primero, la sangre que era líquida y caliente, el segundo, la bilis amarilla que era caliente y seca como el fuego, tercera, la bilis negra que era fría y seca como la tierra; y por último la cuarta llamada puitita o flema que era fría y húmeda como el agua. Las 3 últimas estaban contenidas dentro del humor de la sangre, pero en menor cantidad. Al pasar de los años estos humores se convirtieron en lo que hoy conocemos como la sangre y toda la red hormonal y metabólica que genera nuestro cuerpo y que su equilibrio es finamente controlado. Por ello un estudio de sangre, es una herramienta muy poderosa para el diagnóstico y prevención de muchas enfermedades, ya que en ella se pueden encontrar anormalidades de ciertos órganos y funciones metabólicas del cuerpo.
La química sanguínea (QS) es una prueba de diagnóstico usada muy ampliamente por los médicos ya que incluye “elementos” de valor diagnóstico importantes en las enfermedades con mayor demanda en el país. Es por ello que han sido divididas en “n” cantidad de elementos y así podríamos tener una química sanguínea de 3 elementos, hasta una de 35.
La QS de 34 elementos por lo general consta de los siguientes “mesurandos” (materia, sustancia, fenómeno u objeto que se desea medir):
· Glucosa
· Urea
· Nitrógeno ureico
· Creatinina
· Relación BUN/creatinina
· Ácido úrico
· Colesterol
· Triglicéridos
· Colesterol de alta densidad
· Colesterol de baja densidad
· Colesterol de muy baja densidad
· Índice aterogénico
· Albúmina
· Proteínas totales
· Globulinas
· Relación albúmina/globulina
· Bilirrubina total
· Bilirrubina directa
· Bilirrubina indirecta
· Transaminasa oxalacética
· Transaminasa pirúvica
· Gamma glutamil transpeptidasa
· Fosfatasa alcalina
· Deshidrogenasa láctica
· Amilasa
· Lipasa
· Hierro
· Calcio
· Calcio corregido
· Fósforo
· Magnesio
· Sodio
· Potasio
· Cloruro
Para fines prácticos, se clasificarán de la siguiente forma:
· Metabolismo de los carbohidratos
· Perfil de lípidos
· Perfil hepático
· Función renal y electrolitos
Metabolismo de los carbohidratos
Como bien se sabe, la glucosa es la principal fuente de energía para las células; órganos vitales como el cerebro necesitan casi exclusivamente de esta molécula para su funcionamiento, sin embargo, no es la única fuente de energía que el cuerpo puede emplear para satisfacer sus necesidades, también puede emplear otros azúcares o carbohidratos como son la sacarosa, lactosa y fructosa. El almidón, que es una fuente de carbohidratos importante, provee al cuerpo de estos requerimientos que se absorben por medio del sistema digestivo, donde se convierte en moléculas más simples para poder ser procesadas. Cuando existe un exceso de estos carbohidratos en la sangre, el hígado almacena cierta cantidad para ser aprovechada en tiempos de ayuno.
Pero, ¿por qué es importante medir los niveles de azúcar en sangre? La Diabetes es una de las primeras causas de muerte en el país. Es una enfermedad crónico degenerativa que se caracteriza por sostener hiperglicemia (glucosa alta en sangre) en ayuno. La enfermedad se ha clasificado según el tipo de patogenia que presente:
· Diabetes mellitus tipo 1
o Autoinmune
o Idiopática
· Diabetes mellitus tipo 2
· Diabetes mellitus gestacional
· Diabetes mellitus por enfermedades del páncreas, genéticas o por exposición a fármacos.
Como resultado de esta clasificación, es necesario comprender el funcionamiento del páncreas y el papel que desempeña en la regulación de la glicemia (fig. 1).
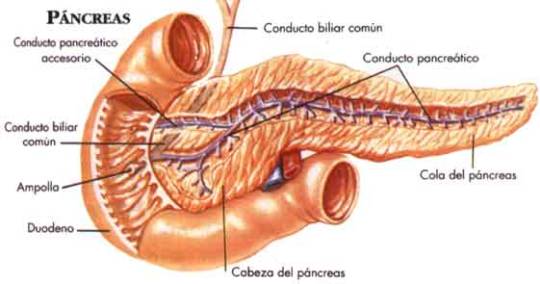
Fig.1. Anatomía del páncreas
De forma general, el páncreas cumple dos tipos de funciones secretoras: las endógenas y las exógenas. Entre las funciones exógenas se encuentra la de drenar el jugo pancreático al duodeno para realizar la digestión de la comida. Mientras que en las funciones endógenas se encuentran los islotes de Langerhands que son las células encargadas de liberar las hormonas responsables de la regulación del metabolismo: insulina, glucagón, somatostatina y el polipéptido pancreático.
La insulina y el glucagón tienen como función regular la cantidad de glucosa en sangre. Cuando la glucosa está por debajo de 60 mg/dL el glucagón se encarga de que se libere glucosa almacenada en forma de glucógeno presente en el hígado. Cuando la glucosa se encuentra por encima de 140 mg/dL en sangre, la insulina se encarga de almacenar y transportar la glucosa a las células del cuerpo. Por ello, monitorear los niveles de glucosa en sangre es un buen método rápido y seguro para descartar enfermedades metabólicas, o más específicamente la diabetes. Claro está que, para diagnosticar cualquier tipo de diabetes, se necesitan realizar más pruebas, pero es ideal para que el médico encienda las luces amarillas y empiece a adentrarse un poco más en la historia clínica: familia con diabetes, hábitos alimenticios, sedentarismo, entre otros. Los valores normales de glucosa en el cuerpo se encuentran entre 60 a 100 mg/dL. Entre las patologías del páncreas se encuentra la pancreatitis aguda, pancreatitis crónica y pancreatitis grave, los signos y síntomas son inespecíficos por lo que se necesita realizar un diagnóstico diferencial. Entre los signos y síntomas que se pueden presentar se encuentran:
· Dolor abdominal
· Nauseas
· Vómito
· Malestar en general
· Inquietud
· Escasas manifestaciones a la exploración física
· Febrícula
· Shock con taquicardia
· Hipotensión
· Manchas equimóticas en región periumbilical (pancreatitis grave)
· Elevación de amilasa y lipasa sérica
La amilasa y la lipasa son enzimas que se encuentran en el páncreas, sin embargo, la amilasa no solo se produce en el páncreas, sino en otros órganos del cuerpo. Para tener una especificidad mayor al 60%, esta enzima debe elevarse en sangre por lo menos 3 veces más de los valores normales (VN: hasta 95 UI/L). La desventaja de la amilasa es que su elevación no se mantiene con la evolución de la enfermedad, ya que se elimina por medio de los riñones, así por ejemplo se pueden hallar cifras normales de amilasa en algunos pacientes con pancreatitis aguda, especialmente cuando esta está asociada a hiperlipidemia, en reagudizaciones de pancreatitis crónica y en casos de pancreatitis aguda de larga evolución. En cambio, la lipasa tiene mayor especificidad para el diagnóstico ya que permanece elevada más tiempo que la amilasa, por lo que su determinación es particularmente útil en fases más tardías de la enfermedad (VN: hasta 70 UI/L).
Perfil de lípidos
Los lípidos son una clasificación empleada para agrupar a todos los compuestos que pueden disolverse en éter, cloroformo o acetona. En el cuerpo humano desempeñan funciones de estructura, almacenamiento y proveedor de energía, y control del metabolismo por ser precursores de varias hormonas importantes. Para nosotros, los lípidos de importancia clínica son el colesterol total, triglicéridos y las lipoproteínas: colesterol de baja densidad (LDL por sus siglas en inglés Low Density Lipoprotein), colesterol de alta densidad (HDL por sus siglas en inglés High Density Lipoprotein) y colesterol de muy baja densidad (VLDL por sus siglas en inglés Very Low Density Lipoprotein). Al igual que los carbohidratos, los lípidos mantienen un equilibrio en la sangre, sin embargo, cuando la regulación de lípidos en la sangre no es efectivo se presentan enfermedades como las dislipidemias.
Las dislipidemias son un grupo de enfermedades que se caracteriza por presentar un aumento de los principales lípidos en la sangre: colesterol y triglicéridos. El impacto de esta enfermedad es que una persona que padezca de alguna dislipidemia, es propensa a presentar ateroesclerosis y riesgos cardiovasculares como infartos. Según la causa de la enfermedad se divide en dislipidemias primarias y secundarias; las primarias son aquellas que tienen causas genéticas mientras que las secundarias son consecuencia del estilo de vida o de otra enfermedad.
Por lo general las dislipidemias secundarias que van de la mano junto con otras enfermedades, como son la diabetes mellitus, la gota, la insuficiencia renal crónica, el hipotiroidismo, el alcoholismo y el síndrome metabólico son las de mayor prevalencia en el país, además, la hipertrigliceridemia (aumento de triglicéridos en sangre) es una causa potencial de sufrir pancreatitis.
Por desgracia, las dislipidemias suelen ser asintomáticas, y cuando se presentan síntomas, estos suelen ser inespecíficos:
· Fatiga crónica
· Disnea (dificultad para respirar)
· Tinnitus (zumbidos en el oído)
· Mareos
· Ataque al estado general
· Dolor abdominal
· Parestesia (cosquilleo, calor o frío)
· Hepatomegalia (inflamación del hígado)
· Esplenomegalia (inflamación del bazo)
Una buena forma de llevar un control de los principales lípidos de la sangre, es realizándose de forma periódica un perfil de lípidos básico, que incluye colesterol, triglicéridos, HDL, LDL y VLDL. Con estas pruebas su médico tendrá una gran herramienta para prevenir estas enfermedades.
Perfil hepático
El hígado, es uno de los órganos más grandes del cuerpo humano (fig. 2, fig. 3) y en él se realizan muchas funciones importantes del cuerpo. Comúnmente se le conoce como la fábrica química del cuerpo ya que entre sus funciones se encuentra la síntesis de proteínas, glúcidos, lípidos (colesterol), ácidos biliares y la urea; así como el de la excreción de la bilis, sales biliares y la bilirrubina.
Otra clasificación de las funciones del hígado es: metabólicas, de almacenamiento, destoxificación e inmunológicas (tabla 1)


La cirrosis, es una de las principales causas de muerte en el país, y por lo general se diagnostica cuando el paciente ya presenta la enfermedad avanzada. Otras enfermedades importantes del hígado son:
· Hepatitis:
o Medicamentosa
o Alcohólica
o Viral: virus de la hepatitis A, B, C, D, E.
· Cirrosis: cirrosis biliar primaria, cirrosis.
· Esteatosis (hígado graso)
· Hepatopatías: Insuficiencia cardíaca
El perfil hepático o comúnmente conocido como “pruebas de función hepática”, de forma general provee información acerca de daño hepático, la severidad de la enfermedad y el curso y pronóstico de la misma. Aunque el nombre conocido sea pruebas de función hepática es preciso mencionar que no todas las pruebas miden funciones fisiológicas identificables. Las pruebas que miden función del hígado son: bilirrubinas, albúmina y tiempo de protrombina. Pruebas como las aminotransferasas, gamma glutamil transpeptidasa y fosfatasa alcalina indican presencia de daño y falta de permeabilidad de las vías biliares. Las globulinas o los anticuerpos tisulares (para infección viral) evalúan la reacción al daño hepático. Además, las pruebas de función hepática ayudan al diagnóstico diferencial de otras enfermedades en las cuales pueden ser anormales como son la sepsis, el infarto agudo de miocardio, brucelosis y la endocarditis bacteriana subaguda, entre otros. Por ello, es importante realizar un chequeo del mismo si se encuentra bajo los factores de riesgo:
· Infección por algún tipo de virus de la hepatitis
· Medicamentos con farmacología hepática
· Abuso del alcohol
· Problemas del corazón
· Deficiencia alimenticia
· Varias parejas sexuales
· Tatuajes o piercings
· Transfusiones sanguíneas
Electrolitos y función renal
El ser humano cuenta con dos riñones, uno de cada lado en la altura de la espalda baja, su función principal es la de filtrar la sangre del cuerpo humano para eliminar los productos de desecho, pero tiene otras que realiza de forma secundaria como son: mantener el equilibrio electrolítico, regular la tensión sanguínea y conservar el pH de la sangre.
Los estudios de función renal van de la mano con otras pruebas que no son por medio de la sangre, por mencionar algunos se encuentran los electrolitos séricos y urinarios, así como el Nitrógeno Ureico en Sangre (BUN por sus siglas en inglés Blood Ureic Nitrogen), la urea, y la creatinina sérica y urinaria.
La insuficiencia renal, es un grave problema de salud, y se encuentra dentro de las 10 primeras causas de muerte en el país; afecta a ambos sexos y tiene mayor prevalencia en hombres que en mujeres. La insuficiencia renal puede ser aguda o crónica. El tipo de insuficiencia está determinado por el tiempo de exposición de los síntomas. En la insuficiencia renal aguda, se presenta una disminución de la eliminación de los desechos en horas o días. En la insuficiencia renal crónica, la disminución se da en un periodo mayor a 3 meses.
La Insuficiencia Renal Aguda (IRA) adquirida se debe en un 70% de los casos a causas prerrenales y en un 17% a causas obstructivas. Si el paciente sobrevive, casi siempre la recuperación de la función renal es total o parcial y el 10-20% continuara con un tratamiento de reemplazo de función renal. En la tabla 2 se resumen las etiologías de la IRA.
Tabla 2. Causas de IRA
Etiología de la insuficiencia renal aguda
Insuficiencia renal aguda prerrenal (baja perfusión renal)
-Deshidratación
· Pérdidas gastrointestinales (diarrea-vómitos), sudoración profusa, baja ingesta
· Líquidos en el tercer espacio (íleo intestinal, pancreatitis, síndrome compartimental)
· Pérdida de sangre: hemorragia aguda
· Quemaduras, síndrome de fuga capilar
· Pérdidas urinarias (diuresis osmótica, nefropatías pierdesal y diuréticos, enfermedad de Addison)
-Bajo gasto cardiaco (isquemia, miocarditis, valvulopatías, taponamiento-derrame grave)
-Síndrome hepatorrenal (tipo 1 y 2)
-Disminución de resistencias periféricas
· Sepsis, cuadros anafilácticos, bloqueo del sistema renina-angiotensina
Insuficiencia renal aguda o parenquimatosa (intrínseca)
Tubulointersticial
-Necrosis tubular aguda isquémica, sepsis (o cualquier infección grave)
-Tóxicos
· Exógenos
o Contrastes yodados para exploraciones radiológicas, especialmente los hiperosmolares (los quelatos de gadolinio a las dosis habituales son poco nefrotóxicas)
o Antimicrobianos: aminoglucósidos, amfotericina B, foscarnet, Aciclovir
o Inhibidores de calcineurina: ciclosporina y tracolimus
o Antineoplásicos: ifosfamida, cisplatino, metotrexato
o Sales de litio
o Antiinflamatorios no esteroideos y antagonistas del sistema renina-angiotensina
o Intoxicaciones: setas tóxicas (amanitas), tetracloruro de carbono, etilenglicol
· Endógenos
o Pigmentos: mioglobina (rabdiomiólisis), hemoglobina (hemolisis grave)
o Uratos y síndrome de lisis tumoral (fosfatos + uratos+ acidemia + oxidantes)
o Cadenas ligeras de inmunoglobulinas e hipercalemia (patología tumoral, hiperparatiroidismo o inmovilizaciones)
-Nefritis intersticial inmunoalergica: fármacos o autoinmune con uveítis (con o sin granuloma)
Glomerular
-Glomerulonefritis extracapilar con anticuerpos antimembranales basal glomerular (con o sin hemorragia pulmonar)
-Glomerulonefritis extracapilar a partir de cualquier glomerulonefritis
-Glomerulonefritis extracapilar pauciinmune (con o sin vasculitis)
-Vasculitis de pequeño vaso
· Poliangitis microscópica (frecuente en piel, pulmón-hemorragia y otros órganos)
· Granulomatosis de Wegener (frecuente afectación de pulmón y otorrinolaringológica)
·�� Enfermedad de Churg-Strauss (eosinofilia y asma bronquial)
-Brote de hematuria macroscópica en la enfermedad de Berger
-Síndrome nefrótico que cursa con insuficiencia renal aguda
Vascular
-Microangiopatías (síndrome hemolítico urémico, purpura trombótica trombocitopénica, hipertensión arterial maligna por administración de mitomicina)
-Enfermedad ateroembolica (cristales de colesterol desde la aorta)
-Embolismo arterial (arritmia cardiaca, placa de ateroma) y trombosis venosa renal
-Vasculitis de vaso mediano y grande (panarteritis nodosa macroscópica, enfermedad de Takayasu)
-Disección de aorta y traumatismo (sección vascular, trombosis, compresión)
-Enfermedades del colágeno (esclerodermia) y lupus eritematoso sistémico (también glomerulonefritis)
Insuficiencia renal aguda obstructiva (posrenal)
-Estenosis uretral (valvas, fibrosis), crecimiento prostático, disfunción vesical
-Neoplasia vesical, neoplasia ureteral bilateral (o unilateral en riñón único)
-Fibrosis retroperitoneal, infiltración por neoplasia retroperitoneal (linfomas, etc.), hematoma
-Litiasis bilateral (o unilateral en riñón único). Cristales o litiasis de urato.
Los electrolitos séricos, ayudan al cuerpo humano a regular la entrada y salida de líquidos de los compartimientos celulares entre otras funciones. Los de importancia clínica son el ion sodio (NA+), ion potasio (K+), ion calcio (Ca2+), ion magnesio (Mg2+), ion cloruro (Cl-), el bicarbonato (HCO3-) y el fosfato (HPO4-).

El sodio, es el ion más abundante del cuerpo, su concentración en sangre tiene una estrecha relación con el ion cloruro. Los valores normales de sodio en sangre oscilan entre 135 a 145 mEq/L. Cuando los valores de sodio están por debajo del límite inferior se dice que el paciente se encuentra en estado de hiponatremia y deshidratación, provocando vómitos y diarreas; enfermedades como el Síndrome de Addison, alto consumo de diuréticos, y problemas renales que evitan la reabsorción del sodio por los túbulos renales, causan hiponatremia. Otro tipo de hiponatremia es el causado por una retención de líquidos llamado hiponatremia-sobrehidratación que se da cuando el cuerpo tiene una secreción excesiva de la hormona antidiurética. Cuando los valores de sodio están por arriba del límite superior se dice que el paciente se encuentra en estado de hipernatremia, esto se da cuando existe una pérdida excesiva de agua que puede ser por falta de producción de la hormona antidiurética que hace que el riñón absorba agua (diabetes insípida) o porque los riñones no son capaces de responder a esta hormona (diabetes insípida nefrógena) o por falta de ingesta de agua. Otra forma de caer en hipernatremia es por un excesivo consumo de sal de mesa que provoca hipernatremia-sobrehidratación. La hipernatremia es un padecimiento poco común, pero su tratamiento debe ser llevado de forma cuidadosa, colocando soluciones hipoosmóticas.
El potasio juega un papel importante en el proceso de excitabilidad del tejido nervioso, corazón y músculos liso y esquelético. Es excretado por el riñón y sus valores de referencia oscilan entre 3.5 a 5.0 mEq/L. Cuando los valores de potasio sérico se encuentran por debajo de estas cifras se dice que el paciente se encuentra en estado de hipopotasemia o hipokalemia, trayendo consigo manifestaciones neuromusculares y cardiacos. Las pérdidas de potasio se asocian a diarreas, vómitos por acidosis metabólica, aspiraciones nasogástricas, pérdidas renales inducidas por la disminución de volumen, hiperaldosteronismo secundario acompañante y por alcalosis metabólica.
Cuando los valores de potasio séricos se encuentran por arriba del límite superior se dice que el paciente se encuentra en estado de hiperpotasemia o hiperkalemia, en particular, este tipo de alteración electrolítica es más grave que las demás ya que puede provocar arritmias ventriculares en cuestión de minutos. Además, la disminución del filtrado glomerular, así como la insuficiencia renal, la diabetes y los fármacos (AINEs, ISSRA, IECAs y ARA 2) puede producir hiperpotasemia.
El ion cloruro, es un anión que participa en muchas funciones del organismo. Entre las más importantes está la de la regulación del pH de la sangre, la formación de ácido clorhídrico para la digestión, contracción muscular, y la regulación del equilibrio ácido-base. Los trastornos del cloro por lo general van de la mano de otros electrolitos como el sodio, potasio y calcio. Los valores de referencia se encuentra entre 98 mEq/L y 108 mEq/L. Entre las causas que pueden ocasionar una baja de este ion (hipocloremia) se encuentra: pérdidas por el aparato digestivo o enfermedad renal; y las que causan su elevación (hipercloremia): disminución del bicarbonato sérico, hiperparatiroidismo, hiperaldosteronismo, toxicidad al salicilato.
El calcio es uno de los componentes más abundantes en el cuerpo humano. Entre las funciones de este elemento se encuentra la contracción del corazón, funciones neuromusculares, sinapsis, coagulación, mineralización del hueso, y funciones hormonales. Los valores normales de calcio son de 8.5 a 10.4 mg/dL, mientras que el calcio iónico se encuentra entre 4.5 a 5 mg/dL.
La hipocalcemia es un trastorno electrolítico que se presenta cuando los niveles de calcio están por debajo de 8.5 mg/dL. Este trastorno se puede deber a disminución o déficit de la hormona paratiroidea intacta (PTH), déficit de vitamina D, pancreatitis, anticonvulsivos o alcoholismo crónico. Por el contrario, se encuentra la hipercalcemia con valores superiores a 10.5 mg/dL que se produce en la mayoría de los casos por resorción ósea, absorción intestinal aumentada o por una disminución de excreción renal. La causa principal de hipercalcemia es el hiperparatiroidismo primario y en enfermos hospitalizados son los tumores.
Las manifestaciones clínicas son las siguientes:
· Neurológicas: ansiedad, depresión alteraciones del comportamiento y de la memoria, confusión, convulsiones, letargia, coma.
· Musculares: debilidad muscular y disminución de los reflejos osteotendinosos.
· Intestinales: estreñimiento, náuseas y vómitos.
· Cardiacas: arritmias cardiacas, hipertensión arterial, calcificaciones valvulares, pulmonares y arteriales.
· Renales: poliuria, disminución de volumen extracelular, disminución del filtrado glomerular.
El fósforo es un elemento que se encuentra en muchas partes del cuerpo humano. Dentro de las células regula numerosos procesos enzimáticos, se encuentra en la estructura del ADN y en las membranas de las células. Además, forma parte de la estructura del hueso y sólo el 1% está como ion fosfato (Pi). Los valores normales oscilan entre 3.0 a 4.5 mg/dL pero estos valores son diferentes según la edad, hora del día, dieta y hormonas.
Se dice que el paciente se encuentra en estado de hipofosfatemia cuando los valores se encuentran por debajo de lo normal. La etiología probable a este trastorno se le amerita a disminución de la absorción intestinal, aumento de las pérdidas urinarias y el paso de Pi desde el espacio extracelular al intracelular.
Para realizar el diagnóstico de la hipofosfatemia el médico se basa en gran parte en la clínica del paciente. La primera aproximación diagnóstica se realiza midiendo la función renal ya que la IRA o IRC son las causas más frecuentes de este trastorno.
El magnesio es un elemento que también está involucrado en muchos procesos del organismo, sobre todo como cofactor de varias vitaminas, interviene en procesos como la adhesión celular, regulación de la estructura ribosómica, transporte de membrana, impulso nervioso, contracción muscular y síntesis de ácidos nucleicos y proteínas. Entre los trastornos del ion magnesio, surgen las mismas causas de déficit que en el fósforo: perdidas intestinales, renales o por la piel, de hecho, la hipomagnesemia (valores bajos de magnesio en sangre) por lo general va acompañado de hipofosfatemia e hipocalcemia. Algunas de las enfermedades en donde se presenta la hipomagnesemia es en la diabetes descompensada, hipertiroidismo, hiperparatiroidismo, sepsis, quemaduras, etc.; mientras que la hipermagnesemia (valores de magnesio mayores a 2.7 mg/dL) se da en lesión renal grave.
Los riñones y los electrolitos, y en general todas las funciones del cuerpo humano, están estrechamente relacionados, por ello si alguno se ve afectado también se verán afectados los demás. Si lo que usted desea es realizarse un chequeo completo de todo el funcionamiento del metabolismo y del funcionamiento de los principales órganos, lo recomendable es hacerse una QS completa. En LV Laboratorios contamos con una amplia gama de “Check up´s” que pueden adaptarse a sus necesidades o a las de su médico.
Referencias:
1. Integración del metabolismo III: adaptación del organismo a la disponibilidad de los nutrientes www.encuentros.uma.es (2010).
2. Reaven, M. Patogénesis del metabolismo anormal de lípidos en pacientes con diabetes mellitus no insulinodependiente, Acta Med Colomb, 2003(18), p. 45-46.
3. Fuentes, X.; Castiñeiras, M.; Queraltó, J. Bioquímica clínica y patología molecular, 2da ed.; Reverté, México.
4. Fisiología pancreática med.javeriana.edu.co 2011
5. Protocolo clínico para el diagnóstico y tratamiento de las dislipidemias www.cenaprece.salud.gob.mx 2011
6. Organización Mundial de la Salud www.paho.org/mex 2013
7. Instituto Nacional de Estadística y Geografía www.inegi.org.mx 2015
8. Izaguirre, R. Evolución del conocimiento sobre la sangre y su movimiento. Parte II. El saber sobre su composición. Iatroquímica de la sangre, Instituto Nacional de Cardiología Ignacio Chávez, México, 2005,1(57).
9. Guías clínicas SEMERGEN 2016.jornadasdiabetes.com 2016
10. Serraga, E. Fisiología de los aparatos y sistemas, 1ra ed.; Gráficas Hernández, Cuenca, 2005; p. 98-103.
11. Bustamante, G. Electrolitos, Revista de Actualización Clínica, México, 2013,39,p. 2017-2022.
1 note
·
View note
Text
ANTÍGENO PROSTÁTICO ESPECÍFICO (PSA). PARA QUE SIRVE ?
QFB. Francisco Bravo Alemán
Jefe de LVLaboratorios Clínicos

El Cáncer o Neoplasia es un problema de salud mundial. La tercera parte del total de Cáncer en hombres corresponde a Neoplasias Urológicas, siendo el Adenocarcinoma de próstata el más común de ellos. Además, es el Cáncer no cutáneo más frecuente en los varones de la mayoría de países industrializados y es la segunda causa de mortalidad por cáncer, después del broncopulmonar.

Los factores de riesgo más importantes en el desarrollo del cáncer prostático son la edad, y esta probabilidad aumenta después de los 50 años. De igual forma, la raza, la nutrición y la genética han sido consideradas en su desarrollo, por lo cual se recomienda realizar un chequeo físico anual.
Estadísticas epidemiológicas muestran que los hombres afroamericanos tienen la más alta incidencia de cáncer de próstata en el mundo. El cáncer de próstata es el tumor maligno sólido más común en los países desarrollados. La probabilidad que tiene un hombre de presentarlo es de 17% y su probabilidad de morir por esta causa es de 3 %. El cáncer de próstata es también el tumor maligno más frecuente del varón mayor de 50 años: su incidencia y la mortalidad que ocasiona han aumentado dado que el promedio de vida del mexicano ha aumentado a 75 años, según un análisis de la población de 2008.
La neoplasia de próstata se mantiene de manera asintomática por varios años, su historia natural no está bien esclarecida y los síntomas más frecuentes no son exclusivos de la enfermedad, cuando aparecen puede haberse diseminado más allá de dicha glándula.
Neoplasia y Disfunción Prostática
Estos signos y síntomas incluyen:
Micción frecuente.
Flujo miccional débil o interrumpido, o necesidad de hacer fuerza para vaciar la vejiga.
Sangre en la orina.
Urgencia de orinar frecuentemente por la noche.
Sangre en el líquido seminal.
Nueva aparición de disfunción eréctil.
Dolor o ardor al orinar, que es mucho menos frecuente.
Molestias al estar sentado, causadas por un aumento del tamaño de la próstata.
A veces, los hombres con cáncer de próstata no manifiestan ninguno de estos cambios. En ocasiones, la causa de estos síntomas puede ser otra afección médica que no sea cáncer. Otras afecciones no cancerosas, como la HBP (Hiperplasia Benigna de Próstata) o un aumento del tamaño de la próstata, pueden producir síntomas similares. Los síntomas urinarios también pueden ser consecuencia de una infección.
Si el cáncer se ha diseminado fuera de la glándula prostática, un hombre puede experimentar:
Dolor en la espalda, las caderas, los muslos, los hombros u otros huesos.
Hinchazón o edema en las piernas o los pies.
Pérdida de peso sin explicación.
Fatiga.
Cambio en los hábitos intestinales.
¿Qué es el antígeno prostático específico?
Desde 1930 se descubrieron enzimas proteolíticas llamadas kalicreínas (de kallicreas, páncreas en griego). En el año de 1970 Ablin y colaboradores aislaron una seminoproteína del tejido prostático y al año siguiente, en 1971, Hara y colaboradores aislaron la misma sustancia que llamó gamma seminoproteína en el semen. En 1973 Li y Beling describieron la Proteína E (prostática) para un uso forense y en 1978 Sensabough a esa misma molécula la llamo proteína P30.
Fue sólo hasta 1979 en que Wang y colaboradores describieron el PSA en el plasma seminal y el tejido prostático y en 1980 Papsidero y colaboradores lo aislaron del suero para que finalmente también en 1980.
En 1987 Schedlich y colaboradores descubrieron la kalicreína 2 (hk2) y en 1998 Reiter y colaboradores el antígeno de células madre de próstata. La kalicreína 2 y la kalicreína 3 son producidas en la próstata y pertenecen a la gran familia de las kalicreínas humanas; son proteínas séricas codificadas por un multigen familiar.
También llamado kalicreína 3, seminina, semenogelasa, el Antígeno Prostático Específico (Prostatic Specific Antigen, en inglés) es una glicoproteína con un peso de 34 kD, integrado por 237 aminoácidos, cuyo gen está activado en el cromosoma 19 del ADN de las células epiteliales de ductos y acinos prostáticos; en condiciones normales es secretado hacia el lumen de estas estructuras, sintetizada por células epiteliales del sistema ductal prostático; es más abundante en el semen, pero una pequeñísima proporción de este PSA pasa a la circulación sanguínea y precisamente es la que se mide para el diagnóstico, pronóstico y seguimiento del cáncer de próstata. El descubrimiento del antígeno prostático se consolidó con la purificación de la proteína del tejido prostático que se dio a conocer en 1979. En 1986, la Food and Drug Administration aprobó el uso del antígeno prostático para la monitorización del cáncer de próstata.
Antígeno Prostático Específico (Kalicreina 3).
La kalicreína 3, más conocida como antígeno específico de próstata (PSA), es una glicoproteína de cadena simple de 237 aminoácidos que se comporta como una enzima proteolítica producida además de las células epiteliales (glandulares) de la próstata, en las glándulas perianales, parauretrales, sudoríparas, tiroides, placenta, mama y endometrio, y también se encuentra en la leche materna. Su función primaria es la licuefacción del semen, antagonizando la acción de la semenogelina, también llamada “antígeno específico vehiculo-seminal”, que es la proteína que produce la coagulación del semen para proteger los espermatozoides durante la eyaculación.
Debe entenderse que la función proteolítica es preferente sobre la de la semenogelina pero no exclusiva, por lo que el organismo toma todas las precauciones para controlar adecuadamente esta enzima destructora de proteínas El PSA alcanza una concentración en el compartimento seminal o luz de la glándula entre 0,5 a 5 mg/mL y es donde la proteasa ejerce su acción primaria, en el interior de la glándula.
La bioquímica del antígeno específico de próstata (PSA) y sus fracciones
Puede decirse de una manera simplificada que el PSA se divide en dos formas básicas: activo e inactivo.
La mayor parte del PSA es inactivo, bien sea porque es “preactivo” (pro-PSA o zimógeno de PSA), porque fue “usado” y sigue como un PSA libre, o porque está “unido a proteínas” como la alfa-2-macroglobulina (AMG) o la alfa-1-antiquimiotripsina (ACT) y es entonces un “PSA complejo”.
Las formas de PSA posibles son las siguientes: La forma no activa denominada pre-pro-PSA es una forma de seguridad que tiene una cadena de 22 aminoácidos adicionales a los 237 básicos del PSA activo y hasta el momento es imposible de medirla por cualquier método.
Otra forma entonces de dividir el PSA para su estudio es en complejo y libre. El PSA complejo o unido (50% a 95% del PSA total) siempre es inactivo puesto que la unión a las proteínas crea una proteasa que está inactivada. La mayor parte (70% a 90%) está unida a la proteína alfa-1-antiquimiotripsina (PSA-ACT) haciendo una unión covalente que es irreversible; un porcentaje variable está unido a la proteína alfa-2-macroglobulina (PSA-AMG) que es reversible, lo que quiere decir que el PSA puede desligarse y volver a ser activo. Otro porcentaje variable del PSA está unido a otras proteínas menos específicas de transporte que son despreciables en volumen. El PSA libre (5% a 50 %) que es proporcional al tamaño de la próstata.
La próstata con cáncer
En la próstata cancerosa ocurren varios fenómenos: la glándula se convierte en autocrina, y se pierde la membrana basal y la capa de células estromales. Sólo queda la parte epitelial o glandular concentrada en su labor de producir PSA cuyo valor aumenta de manera dramática mientras la distorsión del tejido no arruina por completo la función de la glándula.
Las diferentes formas de PSA comienzan a pasar en grandes cantidades al plasma donde las proteínas ligan el exceso haciendo aumentar los valores del PSA total. También pasan algunas cantidades de pro- PSA libre y PSA inactivo libre que deben ser igualmente metabolizados.
El antígeno prostático específico total consta de dos fracciones: libre y compleja, susceptibles de ser cuantificadas en el suero de pacientes afectados por patologías tumorales de próstata, tanto benignas como malignas. Se considera que el nivel del antígeno prostático es alto cuando se encuentra por encima de los 4 ng/dL, con una sensibilidad que oscila entre 67.5 y 80 % y una especificidad de 60 a 80 % para el cáncer de próstata.
Debe entenderse que en el Adenocarcinoma el PSA libre aumenta en términos relativos aunque su porcentaje disminuya con respecto al PSA total. Eso se muestra mejor con un ejemplo: implica matemáticamente un mayor valor ser el 10% (valor anormal de PSA libre) en 50 ng de PSA total (lo que corresponde a 5 ng de libre), que ser el 25% (valor normal de PSA libre) de 2 ng de PSA total (lo que corresponde a 1 ng de libre).
Porcentaje de PSA libre: el PSA se encuentra en la sangre principalmente en dos formas. Una forma está unida (adherida) a proteínas sanguíneas, mientras que la otra es libre (no adherida). La prueba del porcentaje de PSA libre (fPSA) es la proporción de la cantidad de PSA que circula libre, en comparación con el total del nivel de PSA. El porcentaje de PSA libre es menor en los hombres que tienen cáncer de próstata que en los hombres que no tienen esta enfermedad.
Algunas veces, cuando los resultados de la prueba de PSA están en un rango intermedio o “limítrofe” (como entre 4 y 10 ng) esta prueba se utiliza para ayudar a decidir si usted debe hacerse una biopsia de próstata. Un porcentaje menor de PSA libre significa que su probabilidad de tener cáncer de próstata es mayor, y usted probablemente debe hacerse una biopsia.
Muchos médicos recomiendan biopsias para los hombres con un porcentaje de PSA libre de 10% o menos, y recomiendan que los hombres consideren una biopsia si el porcentaje está entre 10% y 25%. El uso de estos valores límite permite detectar la mayoría de los cánceres, y ayuda a evitar biopsias de la próstata innecesarias. Esta prueba se usa ampliamente, pero no todos los médicos están de acuerdo en que el 25% sea el mejor valor límite para decidir si es necesaria una biopsia. Además, el valor límite puede cambiar dependiendo del nivel general de PSA.
PSA y Huesos.
Otro fenómeno que vale la pena comentar es el relacionado con el aumento desmesurado del PSA en los pacientes con metástasis óseas. Las células tumorales en el hueso son capaces de producir grandes cantidades de antígeno que tiene un poderoso efecto mitogénico sobre la proliferación de los osteoblastos que son los directamente correlacionados con las metástasis osteoblásticas del cáncer de próstata.
TACTO RECTAL: EVALUACIÓN PROSTÁTICA.
Las lesiones por carcinoma de próstata pueden ser reconocidas durante el examen de tacto rectal dada su ubicación preferente en la zona periférica de la próstata. Sin embargo, solo el 18% de todos los pacientes con cáncer de próstata son detectados por este examen.

Cuando se utiliza el tacto rectal y el antígeno prostático especfico como exámenes de detección sistemática del cáncer de próstata, las tasas de detección son más altas con el segundo y son máximas con la combinación de las dos pruebas. Con el amplio uso del antígeno prostático específico se produjo un cambio de estadio al diagnóstico a favor de la enfermedad localizada, porque aumenta el tiempo de anticipación hasta la detección del cáncer de próstata. El tiempo de anticipación es el periodo por el cual se adelanta el diagnóstico mediante la detección sistemática.
La combinación de tacto rectal y antígeno prostático específico en suero es la prueba de primera línea para evaluar el riesgo de que se presente un cáncer de próstata en un individuo.
PSA-TACTO RECTAL y BIOPSIA POR ECOGRAFÍA: VENTAJAS.
La tríada de tacto rectal-antígeno prostático específico-biopsia de próstata dirigida por ecografía se utiliza en la detección temprana del cáncer de próstata.
No se recomienda la ecografía transrectal como prueba de detección de primera línea a causa de su bajo valor predictivo en el cáncer de próstata temprano y su alto costo económico. El tacto rectal es un examen que solo tiene buena reproducibilidad en manos de examinadores experimentados y solo identifica a 56 % de los pacientes con cáncer de próstata; su valor predictivo positivo mejora con el uso del antígeno prostático específico. Todo paciente con un tacto rectal sospechoso de cáncer o una elevación del antígeno prostático específico debe someterse a una biopsia de próstata.
No se puede perder de vista la confluencia de factores que potencian el valor del antígeno prostático específico para la mejora del diagnóstico del cáncer de próstata, como la incorporación de la ecografía y la introducción rutinaria y sistematizada de la biopsia prostática ecodirigida, lo que ha dado como resultado una clara mejoría en el diagnóstico.
A QUE EDAD PUEDE APARECER EL CÁNCER PROSTÁTICO ?
El cáncer de próstata rara vez se diagnostica en hombres menores de 50 años de edad: solo en 2% de los casos. La edad media al diagnóstico es de 68 años; 65% es diagnosticado después de los 65 años de edad.
A los 85 años de edad, el riesgo acumulado de cáncer de próstata clínicamente diagnosticado oscila entre 0.5 y 20% en todo el mundo.
Peso corporal, Actividad Física y Alimentación: factores de protección contra el cáncer de próstata.
Frutas y legumbres: Un alto consumo de verduras causa una disminución apreciable en el riesgo de cáncer de próstata, los hombres que consumían un promedio de cuatro o más porciones de verduras al día tenían un riesgo de cáncer de próstata en un 35% inferior en comparación con aquellos que bebieron menos de dos porciones diarias. Las verduras y las hierbas con el mayor efecto de protección fueron los de la familia de la col (repollo, coliflor, coles de Bruselas, brócoli, etc.).
Tomates y jugo de tomate: Varios estudios han identificado el licopeno (que se encuentra en grandes cantidades en los tomates y el jugo de tomate que tiene un fuerte efecto protector. Otros estudios indican que personas que tomaron un suplemento diario de 50 UI de vitamina E mostraron una disminución del 41% de las muertes por cáncer de próstata. Así como hombres que aumentaron la mayor cantidad de selenio en su dieta, tenían un riesgo 51% menor de cáncer de próstata que aquellos que tuvieron la menor ingesta de este mineral.
No coma demasiado: Hombres que comieron más calorías tuvieron un riesgo de cáncer de próstata 2,7 veces más altas que las que consumían menos calorías. Se debe reducir el consumo de grasa; los que consumen demasiada grasa - como animales y vegetales - se enfrentan a un 2-3 veces mayor riesgo de contraer cáncer de la próstata. Las excepciones son el aceite de oliva y grasas omega-3 (como los de linaza y las nueces).
Reducir el consumo de leche y productos lácteos Algunos estudios han relacionado el consumo de productos lácteos y un mayor riesgo de cáncer de próstata.
Los efectos del peso corporal, la actividad física y la alimentación sobre el riesgo de cáncer de próstata no están claros, aunque usted puede tomar medidas que podrían reducir su riesgo.
Los estudios han encontrado que los hombres que están activos físicamente con regularidad tienen un riesgo ligeramente menor de cáncer de próstata. Puede que la actividad vigorosa tenga un efecto mayor, especialmente en el riesgo de cáncer de próstata avanzado.
Varios estudios han sugerido que una alimentación con un alto contenido de ciertos vegetales (incluyendo tomates, vegetales crucíferos, soya, frijoles y otras legumbres) o pescado puede estar asociada a un menor riesgo de padecer cáncer de próstata, especialmente cánceres más avanzados. Los vegetales crucíferos incluyen repollo, brócoli, coliflor.
Aunque no todos los estudios concuerdan, varios han descubierto un mayor riesgo de cáncer de próstata en hombres que tienen una alimentación con un alto contenido de calcio. También puede que haya un mayor riesgo al consumir productos lácteos.
Por ahora, el mejor consejo relacionado con la alimentación y la actividad física para reducir posiblemente el riesgo de padecer cáncer de próstata consiste en:
Coma al menos 2½ tazas de una gran variedad de verduras y frutas cada día.
Manténgase físicamente activo
Mantenga un peso saludable
LVLaboratorios Clínicos, y el PSA al cuidado de su Salud.
Si le preocupa algún cambio que ha experimentado, hable con su médico. Su médico le preguntará desde cuándo y con qué frecuencia ha experimentado el (los) síntoma(s), entre otras preguntas.
El cáncer de próstata no se puede prevenir de manera segura. Muchos factores de riesgo, tales como la edad, la raza, y el antecedente familiar no se pueden controlar. No obstante, existen algunas medidas que puede tomar para tratar de reducir su riesgo de padecer esta enfermedad.
En LVLaboratorios estamos comprometidos con el cuidado y la prevención de su Salud. Ponemos a su disposición una serie de diferentes Check Ups’ para varones de acuerdo a su edad, que incluyen la Determinación del Antígeno Prostático Espécífico (PSA).
El antígeno prostático específico es un indicador en el escrutinio del cáncer de próstata que debe ser solicitado por el médico familiar o general a los varones mayores de 45 años. Ante resultados por arriba de los niveles normales es necesario consultar al urólogo.
Bibliografía
El antígeno prostático específico.Su papel en el diagnóstico del cáncer de próstata
Luis Carlos Sánchez-Martínez, César Armando Paredes-Solís,Octavio Francisco Hernández-OrdóñezItzel Rigel Sánchez-Ruvalcaba. Hospital de Especialidades, Centro Médico Nacional La Raza, Instituto Mexicano del Seguro Social, Distrito Federal, México. Rev Med Inst Mex Seguro Soc. 2013;51(2):124-6
Usefulness of PSA and its fractions in the diagnosis of prostate cancer Xavier Filella, David Truanb, Joan Alcover, Rafael Molina, Pilar Luque, Francisca Coca, Antonio M Ballesta. Med Clin 2004;122:241-4
La bioquímica del antígeno específico de próstata (AEP) y sus fracciones. Juan Fernando Uribe Arcila. Medicina & Laboratorio, Volumen 14, Números 3-4, 2008
0 notes
Text
LUPUS ERITEMATOSO SISTÉMICO
BQD. Larissa Franco Monroy
Químico Analista de LV Laboratorios Clínico.
Abril 2017

¿Qué es el Lupus Eritematoso Sistémico?
El Lupus Eritematoso Sistémico o mejor conocido como LES, es una enfermedad inflamatoria crónica de naturaleza autoinmune, es decir es una condición clínica, en la cual las células autoreactivas o autoanticuerpos destruyen células o tejidos y con esto altera sus funciones, se le conoce como sistémico ya que esta enfermedad no es específica de órgano, es decir, se caracteriza por una afectación de múltiples órganos y sistemas, así como un amplio espectro de manifestaciones clínicas entre los que destacan piel, articulaciones, riñones, pulmones, sistema nervioso central, membranas serosas y otros sistemas provocando daño e inflamación, de igual manera se caracteriza por la presencia de anticuerpos antinucleares (ANA).
La prevalencia es de 51/100,000, afecta principalmente a mujeres jóvenes en edad reproductiva, desde la adolescencia hasta la quinta década de la vida, pero puede aparecer a cualquier edad (durante la infancia o durante la tercera edad; la relación mujer: hombre es de 9:1, el curso clínico es variable con periodos de exacerbación y remisión. En la etiopatogenia de la enfermedad intervienen factores genéticos, hormonales, ambientales e inmunológicos con participación de la respuesta inmune innata y adaptativa, producción de diversos autoanticuerpos específicos y complejos inmunes que producen daño de los tejidos blanco.
El LES puede afectar a diversos grupos étnicos, pero aquellos de raza afro-americana y los asiáticos tienen un riesgo más elevado de desarrollar la enfermedad
Los síntomas varían mucho de un paciente a otro. Los más conocidos y visibles afectan a la piel (es característica la erupción “lúpica”en mariposa en la cara) y lo sufren el 90% de los pacientes.
Se manifiesta alternando períodos de mayor actividad o más síntomas (exacerbación) con otros de inactividad (remisión). Los ataques pueden ser leves o graves.
Al tratarse de una enfermedad autoinmune no tiene cura, sin embargo se puede controlar con fármacos que pueden regular el sistema inmunitario y frenar la inflamación. Además, la irrupción reciente de nuevas terapias biológicas han abierto nuevas vías de tratamiento que mejorarán la calidad de vida de los pacientes.
¿Qué son los anticuerpos antinucleares (ANA)?
Los anticuerpos antinucleares son inmunoglobulinas que reconocen componentes celulares autólogos (nucleares y citoplasmáticos). Además de los ANA autoinmunes, pueden estar en circulación ANA infecciosos y naturales.
Clasificación de los ANA
En circulación pueden estar presentes tres tipos de ANA. Uno de ellos está presente en todos los individuos a títulos relativamente bajos y forman parte del repertorio de los ANA naturales. Por ello, es importante establecer valores de referencia ajustados a las poblaciones que los van a usar como referencia. En un trabajo realizado en el 2005 se mostró la importancia de establecer los valores normales de ANA tomando en cuenta el grupo étnico, el patrón observado y los títulos de los anticuerpos. Un segundo tipo de ANA son los que se producen como resultado de procesos infecciosos. En este sentido, los ANA cuyo origen son los procesos infecciosos no se asocian a manifestaciones clínicas de enfermedad autoinmune y sus títulos bajan en cuanto se resuelve el proceso infeccioso que les dio origen. El tercer tipo es el de los ANA autoinmunes, los cuales reflejan la pérdida de la tolerancia inmunológica y su origen es multifactorial. Su producción depende de carga genética, medio ambiente, cambios hormonales, etc.
La detección de ANA debe realizarse mediante inmunofluorescencia indirecta (IFI) en líneas celulares como prueba de tamizado inicial debido a su alta sensibilidad. Una muestra positiva para ANA, detectados mediante IFI, debe confirmarse mediante técnicas más sensibles y específicas como ELISA, electroinmunotransferencia (Western blot) u otras.
Los ANA detectados por IFI deben ser evaluados en base al patrón y al título. La detección específica de diversos autoanticuerpos (anti-ENA, ADNcd, etc.) resulta útil en el diagnóstico y seguimiento de pacientes con enfermedades autoinmunes. Por tal motivo, su detección debe realizarse de manera ordenada y razonable, empleando las guías o estrategias enfocadas al buen uso e interpretación de la presencia de autoanticuerpos. El objetivo de la revisión es presentar una recopilación de la literatura y nuestra experiencia en la detección y estudio de los ANA.
¿Cuales son las causas?
Se desconoce la causa de esta reacción inflamatoria. Probablemente sea el resultado de una combinación de tendencias genéticas, hormonales (recordando que es una enfermedad mucho más frecuente en las mujeres) y factores ambientales (virus, rayos ultravioleta de la luz solar, medicamentos).
La causa del lupus eritematoso sigue siendo desconocida. Sin embargo, al tratarse de una enfermedad autoinmune hay distintos factores que sí se conocen, que pueden influir y provocar lupus. La más conocida es la alteración en el sistema inmunológico, que entre otras funciones es el encargado de defender al cuerpo frente a posibles infecciones.
Otras de las causas que se barajan responden a la genética. Se ha comprobado que, por ejemplo, en gemelos si uno de los hermanos tiene la enfermedad, el lupus tiende a aparecen con mayor frecuencia en el otro hermano. Sin embargo, aún se desconocen qué genes concretos son responsables de esta enfermedad.
Los factores ambientales también podrían incidir en esta patología. Se considera que por ejemplo, la exposición a la luz solar también podría ser un factor potenciador de la patología. De hecho, muchos individuos con lupus tienen fotosensibilidad a los rayos ultravioletas. Algunos medicamentos también pueden desencadenar un brote de esta patología.
Asimismo, las hormonas, en concreto los estrógenos femeninos, pueden estar implicadas en la enfermedad. De hecho, se ha observado que las píldoras anticonceptivas pueden acelerar su aparición en mujeres genéticamente predispuestas. De esta manera, los brotes de lupus suele ser más común en mujeres en estado fértil.

Síntomas
Al tratarse de una enfermedad multisistémica afecta a varios órganos. Presenta por un lado síntomas generales: El cansancio, la pérdida de peso inexplicable, la fiebre prolongada que no se debe a ningún proceso infeccioso y alteraciones de la temperatura.
La fiebre es un síntoma muy importante porque puede deberse a la propia enfermedad o a una infección que coexiste con el lupus. Es fundamental determinar la fuente para tratarlo de forma adecuada.
Se pueden agrupar los síntomas en:
Síntomas articulares y musculares
Se encuentran dentro de las manifestaciones clínicas más frecuentes. El 90 por ciento de los pacientes con lupus padecen dolor e inflamación en las articulaciones en manos, muñecas, codos, rodillas y pies con más frecuencia. También es posible que aparezca rigidez articular por las mañanas. La artritis puede ser migratoria o episódica.
Estos síntomas suelen producirse al principio de la enfermedad y durante su evolución.
Síntomas dermatológicos
La lesión más conocida, aunque no la más frecuente, es la denominada “eritema en alas de mariposa”, que consiste en un enrojecimiento y erupción de la piel de la cara, en las mejillas y la nariz. Estos síntomas aparecen en el 80 por ciento de los pacientes y muchos de ellos empeoran con la exposición al sol.
También es frecuente la caída del cabello cuando la enfermedad está activa. Por otro lado, los enfermos de lupus presentan hipersensibilidad a los rayos ultravioletas. Si se exponen sin protección la enfermedad puede reactivarse.
Las lesiones de la piel en el lupus aparecen en cualquier parte del cuerpo y en general no dan molestias.
Síntomas cardiacos y pulmonares
Aproximadamente un 25 por ciento de los pacientes pueden padecer afecciones relacionadas con el corazón. Esto se debe a que la capa de revestimiento del corazón (pericardio) se inflaman por la enfermedad. Esta inflamación también se produce en las membranas de revestimiento de los pulmones (pleura), aunque aquí la incidencia sube al 50 por ciento de los casos. Como consecuencia se origina pericarditis y pleuritis. Ambas tienen síntomas parecidos: dolor torácico y fiebre. En otras ocasiones, el lupus afecta a los pulmones o a las válvulas del corazón ocasionando insuficiencia cardiorrespiratoria.
Síntomas en el riñón
El lupus afecta a los dos riñones a la vez. La lesión más frecuente es la inflamación (nefritis), que a veces impide que el riñón elimine adecuadamente los residuos del organismo y estos se acumulan en la sangre, por ejemplo, aumenta la urea en sangre, y aparecen proteínas o sangre en la orina debido a la inflamación, con lo que se produce una hinchazón de cara y piernas. Estas afecciones pueden producirse hasta en el 45 por ciento de los pacientes.
La lesión del riñón es asintomática manifestándose en algunas ocasiones como cansancio o subida de la tensión arterial.
Síntomas neurológicos
Estos son los más variados y graves. Los pacientes con lupus pueden tener trastornos psiquiátricos, cefaleas, estados confusionales, afectación en los nervios periféricos y convulsiones, entre otros.
Se manifiesta con dolores de cabeza, depresiones o situaciones de hiperactividad. Son manifestaciones muy frecuentes en la población general y puede deberse a una inflamación cerebral por lupus o por otras muchas circunstancias. Asimismo, es posible que la depresión no se desencadene por la enfermedad, sino porque el paciente se deprime al saber que se enfrenta con esta patología, de origen desconocido y que puede afectar a tantos órganos del cuerpo.
Síntomas del aparato digestivo
Son los menos frecuentes pero pueden producirse vómitos, diarrea, pancreatitis, alteraciones hepáticas, peritonitis, etc.
Síntomas hematológicos
En el lupus se puede producir una disminución del número de todos los tipos de células sanguíneas. Así, la leucopenia, descenso de glóbulos blancos, puede ser muy frecuente. La anemia también aparece con asiduidad en el desarrollo de la enfermedad, así como abortos. Esto debido al síndrome conocido como “Sindrome antifosfolipido” que se asocia a la presencia de anticuerpos antifosfolipídicos (AAF.) Los AAF mejor conocidos son los anticuerpos anticardiolipina y el anticoagulante lúpico.
Diagnóstico
El diagnóstico del (LES) se basa en 11 criterios, de los cuales se requieren 4 o más de estos criterios, ya sea en secuencia o simultáneamente, durante cualquier intervalo de la observación. Estos criterios fueron publicados en 1982 por el comité de criterios diagnósticos y terapéuticos del American College of Rheumatology (ACR), y fueron revisados en 1992.
Los criterios son los siguientes:
1. Pleuritis: Claro antecedente de dolor pleurítico o frote, o signos de derrame pleural, o bien
2. Pericarditis: comprobada por electrocardiograma o frote o signos de derrame pericárdico.
7. Trastorno renal:
1. Proteinuria persistente mayor a 0,5g/día o mayor de 3+ sino se ha cuantificado, o bien
2. Cilindros celulares: pueden ser de eritrocitos, hemoglobina, granulares, tubulares o mixtos.
8. Trastorno neurológico:
1. Convulsiones: en ausencia de tratamientos farmacológicos o alteraciones metabólicas conocidas; por ej. Uremia, cetoacidosis, o desequilibrio electrolítico, o bien
2. Psicosis: en ausencia de tratamientos farmacológicos o alteraciones metabólicas conocidas; por ej. Uremia, cetoacidosis, o desequilibrio electrolítico.
9. Trastorno hematológico:
1. Anemia hemolítica: con reticulocitosis, o bien
2. Leucopenia: menos de 4.000/mm3 en dos o en más ocasiones
3. Linfopenia: menos de 1.500/mm3 en dos o más ocasiones, o bien
4. Trombocitopenia: menos de 100.000/mm3 en ausencia de fármacos que produzcan esta alteración.
10. Trastorno inmunitario:
1. Preparación de células LE-positivas (Este item fue eliminado de los criterios diagnósticos en la revisión realizada en 1992), o bien
2. Anti-DNA: título anormal de anticuerpos contra DNA nativo, o bien
3. Anti-Sm: Presencia de anticuerpos contra antígeno nuclear Sm.
4. Hallazgo positivo de Anticuerpos antifosofolipídicos (AFL) basado en:
11. Nivel sérico anormal de anticuerpos anticardiolopina IgG o IgM,
12. Resultado positivo para anticoagulante lúpico utilizando un método estándar.
13. Falso positivo en pruebas serológicas de sífilis (VDRL), que persiste por lo menos durante 6 meses y se confirma por pruebas de Treponema pallidum o prueba de absorción de anticuerpo treponémico fluorescente (FTA-Abs).
14. Anticuerpo antinuclear: Un título anormal de ANA por inmunofluorescencia o análisis equivalente en cualquier momento y en ausencia de medicamentos relacionados con el síndrome de lupus de origen farmacológico.
Los criterios de actividad de la enfermedad en el LES se basan en marcadores serológicos que se realizan mediciones seriadas cada mes, y los cambios en los niveles de anticuerpos anti-DNA aparecen como el mejor predictor de actividad clínica. Los anticuerpos C1q son útiles para el seguimiento de compromiso proliferativo renal. Los niveles de factores del complemento C3 like, C4, y funcionalmente, CH50 remanente son parámetros útiles para el monitoreo de la enfermedad.
Tratamiento
El tratamiento de la enfermedad no está supeditado a una sola terapia. Es muy distinto según el órgano al que afecte. Los corticoides se consideran el tratamiento básico puesto que todos los afectados en un momento u otro los precisan.
En manifestaciones menores como la artritis, la pleuropericarditis o las manifestaciones cutáneas se suelen utilizar antiinflamatorios no esteroideos (AINE) junto con corticoides.
Si los órganos dañados son el pulmón, el corazón, el sistema nervioso central o el riñón el tratamiento debe de ser mucho más agresivo y se basa en corticoides en dosis muy altas y complementos con tratamientos inmunosupresores.
Si la enfermedad presenta síntomas como fiebre, cansancio o afecciones cutáneas, el tratamiento será menos agresivo y con corticoides tópicos y/o antipalúdicos.
La alimentación debe de ser completa, sana y equilibrada. No hay ningún alimento perjudicial para el paciente.
Por otro lado, cuando la enfermedad afecta al riñón y sobre todo, cuando hay hipertensión arterial los pacientes tienen que saber que no es recomendable que consuman alimentos salados o condimentados.
Dependiendo de las características individuales, a los pacientes lúpicos se le suele recomendar extremar la protección frente a la exposición solar, especialmente en aquellos que tienen problemas cutáneos, tomar precauciones frente a infecciones, estar al día de vacunaciones específicas, así como unos cuidados especiales durante el embarazo.
Pronóstico
El lupus tiene una variabilidad clínica muy importante y el pronóstico variará según la gravedad de la misma.
De forma genérica, en las últimas décadas el pronóstico ha mejorado mucho ya que hace 40 o 50 años la supervivencia se estimaba en torno al 50 por ciento y hoy se puede equiparar a la de la población general.
Sin embargo, los estudios demuestran que la calidad de vida de estos pacientes es mucho peor por la cronicidad de la patología, la persistencia de las manifestaciones o la necesidad de tener un tratamiento de forma mantenida en el tiempo.
Referencias
Delves P. , Martin S., Burton D., Roitt I. Inmunología. Fundamentos. (2003). 10a edición. Editorial Médica Panamericana.
Cabiedes J., Núñez-Álvarez C. A. Anticuerpos antinucleares. Rev. Mex Reumatol Clin. 2010;6(4):224–230.
Diagnóstico y Tratamiento de Lupus Eritematosos Mucocutáneo México: Secretaría de Salud, 2011.
Ariza K., Isaza P., Gaviria A. M., Quiceno J. M., Vinaccia S., Alvarán L., Pinto L. F., Velásquez C. J., & Márquez J. D. (2010). Calidad de vida relacionada con la salud, factores psicológicos y fisiopatológicos en pacientes con diagnóstico de Lupus Eritematoso Sistémico - LES. Terapia psicológica, 28(1), 27-36.
Gómez-Puerta J. A., Cervera R., (2008). Lupus eritematoso sistémico. Medicina & Laboratorio 2008; 14: 211-223.
Módulo 1 (La clínica y el laboratorio), número 68. Editora Médica Colombiana S.A.,2008.
Adams B. B., Mutasim D. F., (2000). Importancia diagnóstica de la determinación de los anticuerpos antinucleares. Departamento de Dermatología, Facultad de Medicina de la Universidad de Cincinatti, Cincinatti, Ohio. 39: 887-891.
1 note
·
View note
Text
MITOS Y REALIDADES COTIDIANAS DEL COLESTEROL.
Bioquímica Diagnóstica Diana Mariel Mendez Fernández.
Bioquímica Analista. LVLaboratorios.
La prevención puede ser la diferencia entre una excelente Calidad de Vida y el Resto de su vida; vivir restringido en mucho de sus preferencias culinarias. Cifras oficiales estiman que en México más de 22 millones personas registran elevados niveles de colesterol, pero sólo 10% lo sabe. La mayoría ignora que una alta concentración de esta sustancia, aumenta el riesgo de sufrir infartos al miocardio y accidentes cerebrovasculares.

Desde que Virchow encontró placas constituidas de colesterol en 1856 y Anistschow consiguió producir arteriosclerosis en conejos sometidos a dieta rica en grasa y colesterol, la arteriosclerosis es el factor de riesgo más importante de padecer cardiopatía isquémica antes de los 50 años y es independiente de otros factores de riesgo cardiovascular, como la diabetes, el tabaco o la hipertensión arterial. En las personas mayores de 65 años es el segundo factor de riesgo después de la hipertensión.
¿Usted sabe que es el Colesterol?
El colesterol es el principal esterol del organismo humano. Los esteroles son un tipo de grasas naturales presentes en el organismo indispensable para la vida. Se encuentra en la membrana celular de nuestros organismo producido en el hígado. El cuerpo necesita colesterol para fabricar hormonas, ácidos biliares, Vitamina D, y otras sustancias.
El exceso del colesterol en la sangre y su almacenamiento en las arterias puede ser peligroso ocasionando Hipertensión y convertirse en Aterosclerosis taponamiento, estrechamiento y/o endurecimiento de las paredes de las arterias por exceso de colesterol
Las hiperlipemias son un grupo de alteraciones del metabolismo de las grasas que se caracteriza por dar lugar a un aumento de una o varias fracciones lipídicas en la sangre.
Los dos tipos más importantes de grasas circulantes son los triglicéridos y el colesterol.
Se pueden clasificar en hipertrigliceridemias, o aumento de la concentración de triglicéridos; hipercolesterolemias, e hiperlipemias mixtas en las que aumentan tanto el colesterol como los triglicéridos.
Con una dieta adecuada, ejercicio físico y peso adecuado. Si estas medidas no fuesen suficientes, habría que añadir fármacos.
Los que más se utilizan son las estatinas, que además de reducir el colesterol tienen otros efectos beneficiosos sobre las placas de aterosclerosis.
Se ha comprobado que además de bajar el colesterol, la dieta mediterránea mejora más la salud cardiovascular que las dietas que solo bajan el colesterol. Sus principales componentes son: vegetales, pescado, aceite de oliva y frutos secos.
Altos niveles de colesterol no producen una sintomatología clara hasta que ya es demasiado tarde. Cuando la grasa se acumula poco a poco en arterias y venas puede llegar a obstruirlas, de forma disminuye la correcta circulación sanguínea hacia el corazón y al resto del organismo. Como consecuencia de la falta de irrigación sanguínea hacia el cerebro puede producirse un infarto cerebrovascular, mientras que la falta de irrigación sanguínea a una parte del corazón puede dar como resultado la aparición de una angina de pecho y con el paso de los años llegar a producir enfermedades coronarias, que pueden traducirse en un ataque cardíaco.
Un accidente cerebrovascular sucede cuando el flujo de sangre a una parte del cerebro se detiene. Otras referencias lo denominan "ataque cerebral”. Si el flujo sanguíneo se detiene durante algunos segundos, algunas áreas del cerebro no reciben nutrientes y oxígeno suficientes y algunas funciones pueden perderse: el oído, control muscular, habla, memoria corta o larga. Las células cerebrales pueden morir, provocando daño parcial y permanente.
Las principales causas por las que se presenta niveles de colesterol elevado
- Herencia. Causado por un defecto en el cromosoma 19. Este defecto principal se produce por una mutación en el gen que codifica el receptor de LDL (colesterol malo), que son los encargados de eliminar el colesterol de la sangre a nivel hepático. Al disponer de una menor cantidad de receptores, ya sea parcial o total, el colesterol LDL aumenta considerablemente en sangre, favoreciendo su depósito en las arterias y el desarrollo de una placa que puede estrechar la luz de las arterias, lo que produce la ateroesclerosis.
- Enfermedades hepáticas, endocrinas y renales: La administración de ciertas sustancias aumentan la síntesis de las lipoproteínas LDL, que transporta el colesterol perjudicial para el organismo.
- Edad y sexo. El colesterol empieza a elevarse hacia los 20 años y continúa subiendo hasta los 60 o 65 años. El colesterol en los hombres tiende a ser más alto antes de los 50 años que el de las mujeres con esa misma edad. Pero después de los 50 ocurre lo contrario. Los niveles de colesterol LDL en las mujeres tienden a subir con la menopausia.
En LV Laboratorios estamos comprometidos con su salud, con la tranquilidad de su familia y porque sabemos que todas las personas son diferentes, le ofrecemos pruebas para evaluar sus niveles de colesterol así como Triglicéridos, estas determinaciones se encuentran en nuestro PERFIL LIPÍDICO el cual se encuentra dentro de varios de nuestros CHECK UPS
Este perfil de lípidico incluye:
Colesterol HDL
Colesterol LDL
Colesterol VLDL
Triglicéridos
Colesterol Total
Para que los resultados del estudio sean confiables se debe mantener un ayuno mínimo de 8 hrs y máximo de 10 hrs. Se recomienda a nuestros pacientes que el día anterior no se ingiera alcohol o alimentos demasiado grasosos. La prueba se realiza en sangre y el laboratorio emite los resultados comparándolos contra valores deseables; este resultado no se interpreta como normal o anormal sino en función del riesgo implica el tener una mayor o menor proporción de HDL o LDL.
Dicho perfil le ayudará al médico a dar buen diagnóstico ya que cuenta con determinaciones de diferentes clases de colesterol, cada uno cuenta con una función diferente. Colesterol de lipoproteína de baja densidad (LDL) suele denominarse colesterol “malo”. Este tipo lipoproteína ayuda a que el colesterol se adhiere en las paredes de sus arterias.
Colesterol de lipoproteína de alta densidad (HDL-C): el colesterol HDL (HDL-C) denominado colesterol “bueno”. Retira el colesterol de sus arterias y lo lleva a su hígado para que sea eliminado. Se considera que un alto nivel de HDL-C es bueno para su salud cardíaca.
Triglicéridos: los triglicéridos también pueden obstruir las arterias. También los genera el cuerpo, pero ciertos factores pueden aumentar los niveles de triglicéridos: el sobrepeso, la obesidad, no realizar actividad física, fumar, consumir demasiado alcohol, comer demasiados carbohidratos o padecer diabetes. Los antecedentes familiares de altos niveles de triglicéridos también pueden aumentar los niveles.
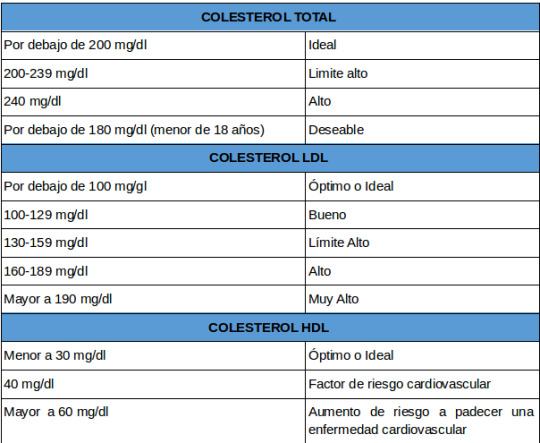
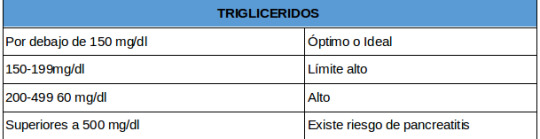
Las lipoproteínas de alta densidad (colesterol HDL)
Constituyen el colesterol “bueno”. En realidad, el HDL (que supone cuarto del colesterol total) actúa como un “destapador” de tuberías, transportando el colesterol desde las paredes arteriales hasta el hígado. De hecho, bajos niveles de HDL (menores de 40 mg para los hombres y menores de 50 mg para las mujeres) están asociados con un aumento de riesgo cardiovascular. (Los cardiólogos saben muy bien que las personas longevas y sanas suelen tener niveles especialmente altos de HDL).
Debido a que todos tenemos un colesterol bueno y otro colesterol malo, no solo es necesario controlar el nivel de colesterol total, sino que resulta fundamental también determinar cuánto hay de uno y de otro en nuestro flujo sanguíneo la lipoproteína de alta densidad HDL, colesterol “bueno”, la lipoproteína de baja densidad (LDL, por sus siglas en inglés) o colesterol “malo” y los triglicéridos.
1.- El colesterol “malo” (LDL) al estar en exceso se adhiere a la elastina de la pared venosa, y deja “pegada” la grasa que contiene, en el interior de las venas.
2.- El colesterol bueno (HDL) “recoge” la grasa circulante o pegada en las venas y la lleva hacial hígado en donde se procesa..
3.-Lipoproteína de muy baja densidad (colesterol VLDL) Las lipoproteínas están compuestas de grasa y proteína. Transportan colesterol, triglicéridos y otras grasas, llamadas lípidos, a distintas partes del cuerpo a través de la sangre.
El HDL o colesterol “bueno” se recomienda que esté por encima de 45 mg/dl, pero tiene un efecto protector de enfermedades cardiovasculares cuando se encuentra por encima de 60 mg/dl. Por lo tanto, si lo tenemos alto, mejor que bajo.
El LDL o malo ese recomienda tenerlo por debajo de 130 mg/dl. Aun así, puede ser que tengamos algún parámetro alterado y que el médico nos diga que el colesterol bueno compensa el malo y que no nos preocupemos. Esta frase hace referencia al índice aterogénico, que relaciona el colesterol total con el bueno y calcula si tenemos riesgo de padecer problemas de salud a causa de los niveles de colesterolemia. Este índice se calcula dividiendo los niveles totales entre el HDL. El resultado debe ser igual o inferior a 4,5 para ser considerado favorable.
En un supuesto donde el total sea de 221 mg/dl y el HDL de 108 mg/dl. El colesterol total sale elevado pero si calculamos el índice aterogénico, veremos que sale correcto:
221 total / 108 HDL = 2,05
Esto quiere decir que, aunque el colesterol total está por encima de 200, no nos debemos preocupar, ya que el índice aterogénico es bajo.
Para comprender como afecta la alimentación sobre la colesterolemia de la sangre, revisamos algunas opiniones populares:
1.En una dieta para bajarlo se debe dejar de comer huevos. Falso: Es cierto que en la yema del huevo hay colesterol. Por este motivo, hace años se aconsejaba limitar su consumo. Se ha podido comprobar que comer huevos con moderación (unas cuatro veces por semana) no afecta negativamente a los niveles de colesterol. La yema del huevo contiene lecitina y biotina, sustancias que ayudan a reducir los niveles de colesterol.
2.Las patatas fritas tienen colesterol. Falso: Ningún alimento de origen vegetal lo contiene. Por lo tanto, las patatas, sean hervidas o fritas, no aportan colesterol al cuerpo. Esto no quiere decir que si tenemos niveles altos y comemos patatas fritas no nos afecte negativamente. Los fritos, son alimentos no aconsejados cuando hay una dislipemia (tener alterados los triglicéridos o el colesterol en sangre).
3. Comer salmón ayuda a bajarlo. Verdadero: El salmón es un pescado azul y aporta omega-3, una grasa cardiosaludable que ayuda a normalizar los niveles de este en sangre.
4. Comer nueces aumenta el HDL. Verdadero: Las nueces contienen ácidos grasos poliinsaturados, concretamente ácido linolénico o omega-3 vegetal que incrementa los niveles de colesterol bueno y disminuye los niveles del LDL o malo y del total.
5. Picar cacahuetes sube el colesterol. Falso: Los cacahuetes no contienen colesterol. Si son fritos, salados y comemos demasiados, pueden provocar un aumento de peso que sí podría afectar a los niveles.
6. El aceite de oliva es cardiosaludable. Verdadero: El aceite de oliva contiene grasas monoinsaturadas y antioxidantes como la vitamina E, que aumentan el HDL, impidiendo la formación de placas de ateroma en las paredes de las arterias.
7. El jamón de bellota no tiene colesterol. Falso: El jamón, sea del tipo que sea, tiene colesterol. En el caso del jamón de bellota, se ha podido comprobar que el perfil de grasas que tiene es cardiosaludable y puede ayudar a mejorar los niveles en sangre. Por lo tanto, siempre y cuando no tengamos la tensión alta, lo podemos comer si lo tenemos elevado.
8. Para bajar el colesterol debemos comer alimentos integrales. Verdadero: Los cereales integrales aportan fibra. La fibra disminuye su absorción procedente de la alimentación y presente en la bilis en el intestino.
9. El queso light es un producto adecuado si tenemos valores altos. Falso: el queso light es más adecuado que el queso original porque contiene al menos un 30% menos de grasa. Aun así aporta grasa y ella está presente.
10. Comer chocolate negro es mejor que el chocolate con leche si tenemos el valores altos. Verdadero: El cacao puede ayudar a reducir los niveles de colesterol en personas con un elevado riesgo de enfermedad cardíaca. No podemos aconsejar comer chocolate a todo el mundo para mejorar los niveles, pero si lo comemos, mejor que tenga un porcentaje elevado de cacao.

Conclusiones
El consumo de grasas es importante para tener unos buenos niveles sanguíneos. La dieta para reducir el colesterol debe ser rica en grasa monoinsaturada como la que hay presente en el aceite de oliva o en el aguacate. También en grasas poliinsaturadas como el omega-3 del pescado azul y su versión vegetal, el ácido linolénico de las nueces. A parte de las grasas hay otras sustancias destacables, como la fibra y los antioxidantes presentes, por ejemplo, en las frutas cítricas, y los esteroles vegetales presentes en las verduras.
No debemos olvidar que si sufrimos sobrepeso u obesidad lo más importante es corregir el peso. Al adelgazar disminuirán los niveles de colesterol y el riesgo de padecer enfermedades cardiovasculares.
Nos vemos en el siguiente Bolletín Médico, esperamos haber contestado algunas de sus dudas más comunes,; en LVLaboratorios su salud y tranquilidad son lo más importante para nosotros.
Referencias
Becker DJ, Gordon RY, Morris PB, Yorko J, Gordon YJ, Li M, et al. Simvastatin vs therapeutic lifestyle changes and supplements: randomized primary prevention trial. Mayo Clin Proc. 2008;83(7):758-64.
Jenkins DJ, Wong JM, Kendall CW, Esfahani A, Ng VW, Leong TC, et al. The effect of a plant-based low-carbohydrate("Eco-Atkins") diet on body weight and blood lipid concentrations in hyperlipidemic subjects. Arch Intern Med. 2009;169(11):1046-54.
Radhika G, Ganesan A, Sathya RM, Sudha V, Mohan V. Dietary carbohydrates, glycemic load
and serum high-density lipoprotein cholesterol concentrations among South Indian adults.
Eur J Clin Nutr. 2009;63:413-20.
Berrade, B. & Chueca, M (2012). Genética de la hipercolesterolemia familiar. Indicaciones de
los estudios genéticos y su utilidad. Revista Española: Endocrinología y Diabetes Infantil. No.2
Merino, G. (2016). Hipercolesterolemia Familiar: evaluación del diagnóstico genético mediante
micromatrices de ADN. Avaliat
0 notes
Text
Anticuerpos anti péptido cíclico citrulinado
Elaborado por:
Q.F.B. Magaly Alcocer Medina
Química Analísta
Si bien recordarán en un tema anterior, se habló acerca de la artritis reumatoide como una enfermedad multifactorial, y que su importancia radica en el problema de salud pública que implica ya que tiene una prevalencia del 1% siendo la población geriátrica la más afectada en la mayoría de los casos, es una enfermedad crónica degenerativa lo que aumenta los costos de la enfermedad porque sus tratamientos son de por vida.
Ciertamente existen varios estudios de laboratorio y de gabinete para el diagnóstico de la artritis reumatoide, entre los que podemos mencionar el factor reumatoide, la proteína C reactiva, la velocidad de sedimentación globular y la clínica del paciente. En este boletín se hablará acerca de la especificidad y sensibilidad predictiva de la citrulina presente en los conocidos péptidos citrulinados.
Años atrás, el factor reumático, la proteína C reactiva y los anticuerpos antinucleares eran las pruebas de laboratorio empleadas para el diagnóstico definitivo de la artritis reumatoide, sin embargo se han ido dejando a un lado debido a su baja especificidad para esta enfermedad, ya que estudios han demostrado que estos analitos pueden elevarse en suero en otras enfermedades de origen autoinmune.
En 1964 se describió por primera vez a los anticuerpos antifactor perinuclear y en 1979 los anticuerpos antiqueratina por Nhienus, Mandema y Young, quienes demostraron que estos anticuerpos presentaban una especificidad del 90 al 98% para la artritis reumatoide. La desventaja de estos analitos era su baja sensibilidad por métodos de inmunofluorescencia convirtiéndolos en poco reproducibles y costosos. Fue hasta 1995 que se descubrió que la filagrina estaba directamente relacionada con los anticuerpos antifactor perinuclear y antiqueratina, ya que estos estaban dirigidos contra la filagrina. Sin embargo la investigación no tuvo éxito al darse cuenta que entre los diferentes grupos de investigación se presentaban resultados completamente discordantes. Fue entonces hasta 1998 que se comprobó que los péptidos con residuos de citrulina en su composición eran necesarios para que los anticuerpos reconozcan a la molécula de filagrina comenzando una nueva era de investigación y estandarización para los anticuerpos anti péptidos citrulinados (anti-CCP).
La citrulina (fig. 1), es un aminoácido sintetizado a partir de la arginina por la enzima peptidil arginina desaminasa (PAD) de la cual existen 5 isoformas; proceso conocido como “citrulinación”, una modificación postraduccional que se da después de la síntesis de aminoácidos . Esta conversión es capaz de activar al sistema inmunológico siendo la expresión de la PAD4 la fuertemente relacionada con la aparición de manifestaciones clínicas de la artritis reumatoide, sin embargo también se ha encontrado PAD2 en el líquido sinovial de pacientes con artritis reumatoide y espondiloartritis.
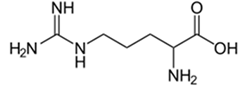
Fig. 1. Estructura química de la citrulina
Las proteínas citrulinadas juegan un papel como neoantígenos, que son presentadas por las células presentadoras de antígeno unidas a moléculas del antígeno de histocompatibilidad HLA-DR , lo que produce una estimulación de las células T, que a su vez estimulan a las células B para producir autoanticuerpos anti péptido cíclico citrulinado (anti-CCP).
La especificidad de esta prueba fue que se hiciera mejorando técnicas de sensibilidad no tan costosas y reproducibles. Actualmente es aceptado el Kit por ELISA de segunda generación de anti-CCP que mantiene su especificidad y aumenta la sensibilidad al 80%. Con los avances tecnológicos de hoy en día, existen otros métodos más rápidos para la cuantificación de los ac. anti-CCP como electroquimioluminiscencia e inmunofluorescencia indirecta (IFI).
El péptido cíclico citrulinado ayuda al diagnóstico prematuro de la artritis reumatoide, además su utilidad diagnóstica radica en que ayuda a diferenciar a los pacientes con artritis reumatoide de los que tienen otra enfermedad como lupus eritematoso sistémico (LES), hepatitis C crónica. La muestra que se emplea para esta prueba es de suero, y los valores de referencia en pacientes normales se encuentra de 0 a 17 UI/mL.
En cuanto a su valor pronóstico, ayuda a predecir qué tan severa será la enfermedad, y puede diagnosticar artritis reumatoide hasta con 10 años antes de presentar signos clínicos lo que la convierte en un marcador específico de la artritis reumatoide.
Elaborado por:
Q.F.B. Magaly Alcocer Medina
Referencias
1. Villegas, G. Anticuerpos anti-péptido citrulinado en el diagnóstico de artritis reumatoide Rev. Med. Hosp. Nac. Niños. Costa Rica, 38(1),2003.
2. Olivares, E.; Hernández, D.; Núñez, C.; Cabiedes, J. Proteínas citrulinadas en artritis reumatoide Lab de Inm y Reu. México, 7(1),2009; p. 68-71.
3. Casillas, F.; Bonilla, D.; Murillo, D.; Corona, E.; Contreras, M.; Saucedo, M.; Saldaña, M. Anticuerpos antipéptido citrulinado cíclico (anti-CCP) en artritis reumatoide. Ins. Inv Reu CUCS, México, 10(1),2015; p. 12-17.
4. Gómez, A. Anticuerpos antipéptidos citrulinados en la artritis reumatoide. Rev Esp Reumatol, España, 31(4),2004; p. 165-168.
5. González, M.; Rueda, J.; González, H.; Salcedo, M. Utilidad diagnóstica del anticuerpo antipéptido cíclico citrulinado como prueba diagnóstica en pacientes con artritis reumatoide. Rev. Colomb Reumatol, Colombia, 20(1)2013; P. 9-18.
6. Barquero, A. Papel del péptido cíclico citrulinado (PCC) en el diagnóstico de la artritis reumatoide. Rev Med Universidad de Costa Rica, Costa Rica, 4(1),2010; p. 18-21.
7. Zuñiga, A. Determinación del péptido cíclico citrulinado como marcador diagnóstico en pacientes con artritis reumatoide. Fundación Cátedra Iberoamericana, Santiago de Guayaquil; pp. 5-17.
1 note
·
View note
Text
Anticuerpos anti péptido cíclico citrulinado
Elaborado por:
Q.F.B. Magaly Alcocer Medina
Química Analísta
Si bien recordarán en un tema anterior, se habló acerca de la artritis reumatoide como una enfermedad multifactorial, y que su importancia radica en el problema de salud pública que implica ya que tiene una prevalencia del 1% siendo la población geriátrica la más afectada en la mayoría de los casos, es una enfermedad crónica degenerativa lo que aumenta los costos de la enfermedad porque sus tratamientos son de por vida.
Ciertamente existen varios estudios de laboratorio y de gabinete para el diagnóstico de la artritis reumatoide, entre los que podemos mencionar el factor reumatoide, la proteína C reactiva, la velocidad de sedimentación globular y la clínica del paciente. En este boletín se hablará acerca de la especificidad y sensibilidad predictiva de la citrulina presente en los conocidos péptidos citrulinados.
Años atrás, el factor reumático, la proteína C reactiva y los anticuerpos antinucleares eran las pruebas de laboratorio empleadas para el diagnóstico definitivo de la artritis reumatoide, sin embargo se han ido dejando a un lado debido a su baja especificidad para esta enfermedad, ya que estudios han demostrado que estos analitos pueden elevarse en suero en otras enfermedades de origen autoinmune.
En 1964 se describió por primera vez a los anticuerpos antifactor perinuclear y en 1979 los anticuerpos antiqueratina por Nhienus, Mandema y Young, quienes demostraron que estos anticuerpos presentaban una especificidad del 90 al 98% para la artritis reumatoide. La desventaja de estos analitos era su baja sensibilidad por métodos de inmunofluorescencia convirtiéndolos en poco reproducibles y costosos. Fue hasta 1995 que se descubrió que la filagrina estaba directamente relacionada con los anticuerpos antifactor perinuclear y antiqueratina, ya que estos estaban dirigidos contra la filagrina. Sin embargo la investigación no tuvo éxito al darse cuenta que entre los diferentes grupos de investigación se presentaban resultados completamente discordantes. Fue entonces hasta 1998 que se comprobó que los péptidos con residuos de citrulina en su composición eran necesarios para que los anticuerpos reconozcan a la molécula de filagrina comenzando una nueva era de investigación y estandarización para los anticuerpos anti péptidos citrulinados (anti-CCP).
La citrulina (fig. 1), es un aminoácido sintetizado a partir de la arginina por la enzima peptidil arginina desaminasa (PAD) de la cual existen 5 isoformas; proceso conocido como “citrulinación”, una modificación postraduccional que se da después de la síntesis de aminoácidos . Esta conversión es capaz de activar al sistema inmunológico siendo la expresión de la PAD4 la fuertemente relacionada con la aparición de manifestaciones clínicas de la artritis reumatoide, sin embargo también se ha encontrado PAD2 en el líquido sinovial de pacientes con artritis reumatoide y espondiloartritis.

Fig. 1. Estructura química de la citrulina
Las proteínas citrulinadas juegan un papel como neoantígenos, que son presentadas por las células presentadoras de antígeno unidas a moléculas del antígeno de histocompatibilidad HLA-DR , lo que produce una estimulación de las células T, que a su vez estimulan a las células B para producir autoanticuerpos anti péptido cíclico citrulinado (anti-CCP).
La especificidad de esta prueba fue que se hiciera mejorando técnicas de sensibilidad no tan costosas y reproducibles. Actualmente es aceptado el Kit por ELISA de segunda generación de anti-CCP que mantiene su especificidad y aumenta la sensibilidad al 80%. Con los avances tecnológicos de hoy en día, existen otros métodos más rápidos para la cuantificación de los ac. anti-CCP como electroquimioluminiscencia e inmunofluorescencia indirecta (IFI).
El péptido cíclico citrulinado ayuda al diagnóstico prematuro de la artritis reumatoide, además su utilidad diagnóstica radica en que ayuda a diferenciar a los pacientes con artritis reumatoide de los que tienen otra enfermedad como lupus eritematoso sistémico (LES), hepatitis C crónica. La muestra que se emplea para esta prueba es de suero, y los valores de referencia en pacientes normales se encuentra de 0 a 17 UI/mL.

En cuanto a su valor pronóstico, ayuda a predecir qué tan severa será la enfermedad, y puede diagnosticar artritis reumatoide hasta con 10 años antes de presentar signos clínicos lo que la convierte en un marcador específico de la artritis reumatoide.
Elaborado por:
Q.F.B. Magaly Alcocer Medina
Referencias
1. Villegas, G. Anticuerpos anti-péptido citrulinado en el diagnóstico de artritis reumatoide Rev. Med. Hosp. Nac. Niños. Costa Rica, 38(1),2003.
2. Olivares, E.; Hernández, D.; Núñez, C.; Cabiedes, J. Proteínas citrulinadas en artritis reumatoide Lab de Inm y Reu. México, 7(1),2009; p. 68-71.
3. Casillas, F.; Bonilla, D.; Murillo, D.; Corona, E.; Contreras, M.; Saucedo, M.; Saldaña, M. Anticuerpos antipéptido citrulinado cíclico (anti-CCP) en artritis reumatoide. Ins. Inv Reu CUCS, México, 10(1),2015; p. 12-17.
4. Gómez, A. Anticuerpos antipéptidos citrulinados en la artritis reumatoide. Rev Esp Reumatol, España, 31(4),2004; p. 165-168.
5. González, M.; Rueda, J.; González, H.; Salcedo, M. Utilidad diagnóstica del anticuerpo antipéptido cíclico citrulinado como prueba diagnóstica en pacientes con artritis reumatoide. Rev. Colomb Reumatol, Colombia, 20(1)2013; P. 9-18.
6. Barquero, A. Papel del péptido cíclico citrulinado (PCC) en el diagnóstico de la artritis reumatoide. Rev Med Universidad de Costa Rica, Costa Rica, 4(1),2010; p. 18-21.
7. Zuñiga, A. Determinación del péptido cíclico citrulinado como marcador diagnóstico en pacientes con artritis reumatoide. Fundación Cátedra Iberoamericana, Santiago de Guayaquil; pp. 5-17.
1 note
·
View note
Text
TEMORES, TUMORES, CÁNCER Y SU PREVENCIÓN
QFB. Francisco Bravo Alemán Jefe de LVLaboratorios.
MARCADORES TUMORALES
La contaminación, el stress, una alimentación indecuada por largas jornadas de trabajo, el exceso de aditivos químicos para saborizar y conservar la mayoría de los alimentos; pero sobretodo la Herencia Familiar hace posible que de un instante a otro, pueda aparecer un Tumor y este convertirse en Cáncer. Separarnos de nuestro seres queridos, alterar nuestros proyectos y presentar algunos períodos de confusión y dolor.
En general, un tumor (Benigno o Maligno) es el crecimiento acelerado de un conjunto de células en un tejido u órgano; este, al aumentar su tamaño y/o numero, se convierte en Tumor. Cuando este Tumor hace perder la función adecuada de uno o más órganos, se convierte en Cáncer.
Hoy en día, así como la diabetes, la hipertensión y otros padecimientos pueden ser controlados a tiempo, retardar su aparición e incluso evitarla; los tumores también pueden ser minimizados antes de alcanzar su mayor crecimiento. Existen numerosas pruebas de Laboratorio que si usted se realiza de forma preventiva y periódica, le ayudaran a conservar la tranquilidad para sus seres queridos.
En LV Laboratorios estamos comprometidos con su salud, con la tranquilidad de su familia y porque sabemos que todas las personas son diferentes, le ofrecemos pruebas para evaluar la probable aparición de un Tumor o Cáncer. Estas pruebas son personalizadas, de acuerdo a su edad, sexo, hábitos laborales, costumbres alimenticias y sobretodo a sus antecedentes familiares.
Venga con nosotros, le realizaremos una Historia Clínica con 100% de confidencialidad y le podremos sugerir exámenes adecuados y específicos de acuerdo a cada persona; por lo que lo invitamos a leer y compartir el siguiente resumen que hemos redactado para ustedes, nuestros médicos y pacientes.
Los MT son sustancias de naturaleza peptídica o lipídica; que pueden ser sintetizados por el mismo tumor o ser una respuesta del organismo ante la presencia del cáncer. Algunos de estos MT son específicos para un solo tipo de cáncer, mientras que otros son inespecíficos, ya que aparecen en varios tipos de cáncer. Estos MT se utilizan para evaluar la presencia o ausencia de Tumores o Cáncer, la respuesta del paciente a su tratamiento o para prevenir su regreso. Los MT se deben interpretar conjuntamente con otras pruebas, exploraciones, biopsias, ultrasonido y/o tomografías; y se pueden detectar en sangre, orina o tejidos corporales en cantidades superiores a lo normal.
Para realizar el diagnóstico del cáncer, se determina la cantidad de estos MT en la sangre y, si se ha realizado una biopsia en el mismo tumor, es mucho mejor. Los MT permiten determinar las características de un tumor, su agresividad, rapidez de crecimiento y/o malignidad. Un MT no debe interpretarse de forma aislada como única prueba porque, en ocasiones pueden estar elevados en sujetos bajo condiciones benignas o porque no son del todo específicos de un tipo de cáncer.
De forma Bioquímica, los MT son un conjunto de sustancias que se pueden identificar como antígenos de membrana asociados a órganos y tejidos que han perdido su crecimiento normal, su metabolismo o han visto alterarse su reloj biológico hasta convertirse en un tumor.
Moléculas tipo glucoproteínas (mucinas) de elevado peso molecular, algunas son hormonas, otras enzimas, proteínas o metabolitos celulares; sustancias que pueden ser medidas cuantitativamente, por métodos inmunohistoquímicos o bioquímicos ya sea en tejidos (biopsias) y fluidos biológicos para identificar la presencia de un cáncer o tumor, el órgano donde reside, su tratamiento y hasta su evolución.
ANTECEDENTES HISTÓRICOS.
La primera referencia histórica a un MT es de hace más de 150 años, cuando Bence-Jones, tras acidificar la orina de un paciente afectado de lo que antes se denominaba mollitis osseum (osteomalacia), observó en ese fluido biológico un precipitado de pesado. 100 años después se supo que esas «proteínas de Bence-Jones» corresponden a cadenas ligeras monoclonales de inmunoglobulinas, cuyas concentraciones se incrementan en los pacientes con mieloma múltiple. Sin embargo, a pesar de esa lejana referencia, la historia de los MT inicia todavía desde hace relativamente poco tiempo.
Así, basta recordar las fechas del descubrimiento de los primeros MT: la gonadotropina coriónica (hCG) en 1927, la hormona adrenocorticotropa (ACTH) en 1928; enzimas como la fosfatasa alcalina y la fosfatasa ácida (F.Ac) como primer marcador tumoral para el cáncer de próstata, fue descubierta a finales de la década del 30 del siglo pasado y utilizada hasta 1990, cuando fue reemplazada por su versión más específica, la fosfatasa ácido prostática, para finalmente, ser desplazadas por el antígeno específico de próstata (PSA) descubierto en 1979 por Wang y colaboradores. En 1963 se descubrió la alfafetoproteína (AFP) como marcador del hepatocarcinoma y en 1965 el antígeno carcinoembrionario (ACE) como marcador de las neoplasias colorrectales la fosfatasa ácida en 1938,
Sin embargo, el despegue definitivo de la utilización clínica en el tratamiento de tumores y el uso de los MT en su evolución y tratamiento toma auge de diferentes sucesos trascendentales: el desarrollo de los análisis modernos de ligando-receptor en 1960 y de los principios para la producción de anticuerpos monoclonales. En las décadas de los 70s’ y 80s’ la patología del Tumor o Cáncer se comprendió mucho mejor, ya el avance médico y científico genero los conceptos de oncogenes y genes supresores de tumor, las alteraciones cromosómicas y los microarreglos (microarray) genéticos, así el desarrollo de la Bioinformática (a principios del siglo XXI).
Por otra parte, el desarrollo de tecnologías innovadoras favorecerieron la asignación de los Premios Nobel por el descubrimiento del radioinmunoanálisis a Berson y Yalow en 1958; y a Köhler y Milstein por el descubrimiento de los anticuerpos monoclonales en 1975. Estas metodologías innovadoras permitieron la identificación de otros MT como el antígeno de cáncer de ovario el 125 (CA 125), el antígeno de cáncer de mama 15-3 (CA 15-3) y el antígeno de cáncer digestivo19-9 (CA 19-9).
Hasta ahora, el único marcador tumoral que ha ganado aceptación amplia como herramienta de detección temprana es el antígeno específico de la próstata (PSA, por sus siglas en ingles) para el cáncer de la próstata. Otros marcadores son algo inespecíficos (demasiados positivos falsos, conduciendo a exámenes de seguimiento costosos e innecesarios), o no se elevan hasta que el cáncer ha avanzado, y por lo tanto el cáncer no se puede detectar antes de que cuando los síntomas comiencen a aparecer. Tenga presente que algunas sustancias utilizadas como marcadores se producen naturalmente en el cuerpo, y un nivel “normal” no es siempre cero.
Los marcadores tumorales no se elevan en todos los casos de los cánceres, y no son provechosos en todos los pacientes. Por ejemplo, el antígeno carcinoembrionario (CEA, por sus siglas en ingles) se utiliza para detectar la recurrencia del cáncer del colon, pero solo se produce en 70-80% de los casos del cáncer del colon. Además, los solamente 25% de los casos que se limitan al colon (primeras etapas) tienen el CEA elevado, así que no siempre se puede detectar el cáncer del colon en sus primeras etapas. Al fin y al cabo, los MT pueden son muy útiles en evaluar la respuesta al tratamiento y a la recurrencia, pero no deben sustituir la exploración física, la evaluación de síntomas, o los estudios radiológicos (exploración de CT o TAC, MRI, PET, etc.).
TABLA 1. MARCADORES TUMORALES MAS UTILIZADOS/CONOCIDOS

Son varios los MT que han salido al mercado científico que han demostrado su utilidad clínica, pero algunos otros aún no alcanzan el cien por ciento sensibilidad/especificidad de un Cáncer. Algunos de los siguiente MT se utilizan de forma frecuente , pero con precaución en su interpretación:
Activador del plasminógeno urocinasa (uPa) e inhibidor del activador del plasminógeno (PAI-1): Cáncer de seno .
Análisis de mutación del gen EGFR: Cáncer de Pulmón.
Análisis de mutación del gen KRAS: Cáncer colonrrectal.
CA27.29: Tipo de cáncer: Cáncer de Seno.
Enolasa neuronal específica (NSE). Neuroblastoma y Cáncer de pulmón.
Cuide su salud, un análisis a tiempo vale la tranquilidad de usted y su Familia.
Esperamos haberle informado de manera comprensible; estamos a sus ordenes y de requerirlo contamos con convenio con el Centro de Imagenologia para la realización de pruebas complementarias.
LV Laboratorios; Calidad en Resultados, Calidez en el trato
Referencias
Abeloff, M., Armitage, J., Niederhuber, J., Kastan, M. & McKenna, G. (Eds.): Clinical Oncology (2004). Elsevier, Philadelphia, PA.
Perkins GL, Slater ED, Sanders GK, Prichard JG. Serum tumor markers. Am Fam Physician 2003;68:1075-82.
Sanchez Yamamoto D, Hallquist Viale P, Roesser K, Lin A. The clinical use of tumor makers in select cancers: are you confident enough to discuss them with your patients? Oncol Nurs Forum 2005;32:1013-22; quiz 1023-4.
Bigbee W, Herberman RB. Tumor markers and immunodiagnosis. In: Bast RC Jr., Kufe DW, Pollock RE, et al., editors. Cancer Medicine. 6th ed. Hamilton, Ontario, Canada: BC Decker Inc., 2003.
Andriole G, Crawford E, Grubb R, et al. Mortality results from a randomized prostate-cancer screening trial. New England Journal of Medicine 2009; 360(13):1310–1319.
Schröder FH, Hugosson J, Roobol MJ, et al. Screening and prostate-cancer mortality in a randomized European study. New England Journal of Medicine 2009; 360(13):1320–1328.
Buys SS, Partridge E, Black A, et al. Effect of screening on ovarian cancer mortality: the Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Randomized Controlled Trial. JAMA 2011; 305(22):2295–2303.
Cramer DW, Bast RC Jr, Berg CD, et al. Ovarian cancer biomarker performance in prostate, lung, colorectal, and ovarian cancer screening trial specimens. Cancer Prevention Research 2011; 4(3):365–374.
Sparano JA, Gray RJ, Makower DF, et al. Prospective validation of a 21-gene expression assay in breast cancer. New England Journal of Medicine 2015; First published online September 28, 2015.
2 notes
·
View notes
Text
La Alfafetoproteína, un marcador bioquímico muy versátil.
QFB. Francisco Bravo Alemán
Jefe de LV Laboratorios.
La alfafetoproteína (AFP) es una Glicoproteína con peso molecular de 60 a 70000 Daltons, codificada para su síntesis en el brazo largo del cromosoma 4; abundante en el feto y análoga a la albumina en el adulto (en propiedades fisicoquímicas), es sintetizada sucesivamente en el saco vitelino y el hígado fetal. La máxima concentración en el suero fetal se observa entre las semanas 12 y 14 de gestación y declina hasta el momento del parto.
En el suero materno la concentración de (AFPSM) se incrementa desde la semana 14, alcanzando su mayor valor entre las semanas 28 y 32. La alfafetoproteína es normalmente secretada hacia el líquido amniótico, atraviesa la barrera placentaria por lo puede medirse en sangre materna. Diversas condiciones patológicas como los defectos abiertos del tubo neural (DTN), Onfalocele, Gastrosquisis, bandas amnióticas, desprendimiento de placenta y hemorragias feto maternas, así como la realización de procedimientos invasivos, entre ellos la amniocentesis, la cordocentesis y la biopsia de vellosidades coriales, aumentan la concentración de alfafetoproteína sérica materna.
En 1972 se informó por primera vez que niveles elevados de AFP materna estaban asociados con fetos que presentaban anacefalia y espina bífida, por lo que en los años 8Os’ se establecieron programas de tamizaje, primero en Gran Bretaña, Estados Unidos y otros países, con el fin de reforzar la detección prenatal del DTN. Conforme avanzaron los estudios. se encontró que niveles anormales tanto altos como bajos son predictivos de otras patologías adicionales, como embarazo molar, aborto retenido, prematuridad, muerte fetal, sobre estimación de la edad gestacional y, más recientemente, síndrome de Down. Bajo el nombre de DTN se agrupan una serie de anomalías congénitas como anencefalia, espina bífida, mielomeningocele, encefalocele y algún área expuesta de la médula espinal.
La medición de la AFP se utiliza bajo 2 criterios diferentes:
En mujeres embarazadas como screening prenatal y control del embarazo; de preferencia se debe realizar la extracción entre las semanas 15 y 22 de gestación y puede ser repetido a la semana en caso de hallarse un valor elevado. Valores elevados en sangre materna pueden tener una alta relación con riesgo de muerte fetal.
Los valores de AFP han sido asignados sobre la base de semanas completas de gestación; por ejemplo: un espécimen que tiene 18 semanas y 6 días de gestación, es asignado a 18 semanas. Es importante mencionar que cuando la AFP se utiliza como criterio de evolución del embarazo las unidades de medición recomendadas son en MoM (múltiplos de la mediana).
Valores bajos de la concentración materna de alfafetoproteína (0.5-0.8 MoM) se han asociado a la presencia de alteraciones cromosómicas fetales. Se considera normal “múltiplos de la mediana” entre 0,5-2,5.
La ventana óptima para el muestreo de la alfa fetoproteína en suero materno se encuentra entre las 15 y 20 semanas de gestación, durante ese tiempo las concentraciones de alfa fetoproteína en suero materno se incrementan en aproximadamente 12 a 15% por semana, habitualmente las concentraciones se encuentran entre 15 y 120 µg/L. Sin embargo, la variabilidad en los resultados del estudio depende de factores que afectan las concentraciones de alfafetoproteína, así como la estandarización y precisión del mismo, lo cual crea la necesidad de establecer “rangos normales” por cada semana de gestación y utilizar una unidad que considere estos factores, por lo que se establecen los múltiplos de la mediana (MoM). Estos Valores MoM son relativos, ya que deben ser corregidos por factores específicos para cada embarazada como peso materno, número de fetos, tabaquismo, embarazo asistido, raza y la existencia de diabetes mellitus insulino dependiente materna. Estas correcciones son desiciones médicas y en ocasiones apoyadas en sofisticados softwares.
Los valores se expresan como múltiplos de la mediana (MoM) y se obtienen dividiendo la concentración encontrada en la paciente por la mediana correspondiente a la semana de gestación. Se consideran valores de corte hasta 2 - 2,5 MoM y cada laboratorio deberá elegir su propio valor de corte. Se debe sospechar la existencia de un DCTN cuando los valores obtenidos son superiores a 2 -2,5 MoM. No obstante, es preciso excluir un resultado falso positivo, pues pueden hallarse cifras elevadas en diversas situaciones a tener en cuenta: errores de cálculos en la edad gestacional, embarazo múltiple, sangrados, muerte fetal, isoinmunizaciones Rh y enfermedades maternas (hepatomas).
En el screening prenatal hallazgos de AFP elevados en el suero materno (semanas 16 y 18) puede indicar la presencia de defectos del cierre del tubo neural (DTN), espina bífida y otras patologías fetales; estos hallazgos deben siempre corroborarse por ecografía de la espina fetal para detectar falsos positivos (embarazo gemelar, amenaza de aborto, nefrosis cong��nita, etc.).
Existen algunas condiciones del feto que pueden producir niveles bajos de AFPSM, como la trisomía 21 (síndrome de Down) y la trisomía 18 (síndrome de Edwards), llama la atención que en su mayoría son menores de 35 años y casi todos los bebés con otras trisomías cromosómicas nacen del mismo grupo de mujeres.
Valor de referencia:
Personas Embarazas (screening Prenatal).
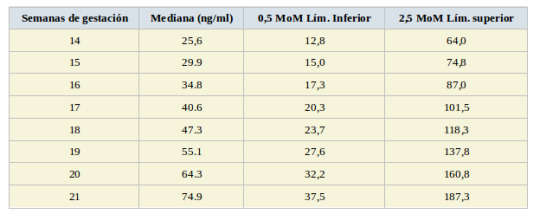
MOM: (múltiplos de la mediana): Se obtienen dividiendo el valor de AFP del paciente por la mediana de AFP para un embarazo normal de la misma edad gestacional.
En los últimos años, donde algunas pacientes embarazadas no presentan historia familiar de estos trastornos genéticos, el uso clínico de la AFPSM se ha asociado al escrutinio rutinario de otros marcadores bioquímicos asociados también con el síndrome de Down: la gonadotrofina coriónica (hCG), el estriol no conjugado, la inhibina y los más recientemente conocidos como la proteína placentaria A asociada al embarazo (PAPP-A) o la sub-unidad Beta libre (Beta hCG libre).
Por lo tanto, la determinación de AFPSM, en forma aislada o en conjunto con otros marcadores (bioquímicos y/o ecográficos) tiene un gran valor en la pesquisa de defectos congénitos.
En el primer trimestre, la valoración del riesgo de cromosomopatía se obtiene analizando un Doble Marcador: PAPP-A (proteína producida por el feto), y la beta-HCG libre cuantitativa (inapropiado coriónica humana, producida por la placenta), ambas presentes en la sangre de la madre , así como la valoración de la TN (traslucencia nucal) medida por ecografía.
En el segundo trimestre, la valoración del Triple Marcador se obtiene combinando AFP (alfafetoproteína producida por el feto), beta HGC y el estriol libre (estrógeno producido por el feto y la placenta). En algunos casos se realiza una prueba cuádruple, añadiendo un cuarto parámetro: inhibina A (IA) producida por la placenta.
Adultos No Gestastes.
La detección de un valor anormal de AFPS no solo es útil como indicador natal
En el adulto y mujeres no gestando, niveles elevados de AFP pueden hallarse en pacientes con hepatoma primario y tumores de células, en enfermedades hepáticas no malignas (necrosis hepática masiva, hepatitis aguda, cirrosis alcohólica, hepatitis crónica activa, hemocromatosis, porfiria cutánea tardía), usualmente niveles inferiores a 500 ng/ml. Tirosinemia hereditaria, ataxia- telangectasia y síndrome nefrótico congénito, ictericia por daño hepatocelular en el recién nacido. Cáncer gástrico (21%), cáncer colorrectal, cáncer biliar, cáncer pancreático, cáncer de pulmón usualmente en conjunto con metástasis hepática (valores inferiores a 500 ng/ml), cáncer metastásico de mama, cáncer de vejiga.
Por lo cual, se utilizan los siguientes valores como referencia.
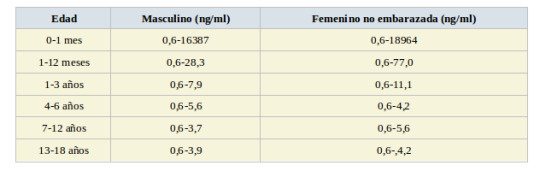
Adultos no gestantes: hasta 10 ng/ml (Factor: ng/ml = UI/ml x 1,21). Dependiendo la metodología empleada y cada fabricante, las unidades de medida pueden reportarse en ng/ml o UI/ml.
La AFP es un importante marcador del carcinoma hepatocelular incremento de AFP en pacientes considerados libre de metástasis puede indicar la presencia de las mismas (carcinoma hepatocelular primario). Su uso combinado con HCG es altamente predictivo para la recurrencia de cáncer de testículo. Es útil en pacientes con alto riesgo de tumores de células germinales, por ejemplo: criptorquidia e individuos saludables susceptibles a tumores testiculares.
Bibliografía:
Gerulewicz-Vannini D, Hernández-Andrade E. Pruebas bioquímicas en sangre materna para la identificación de fetos con riesgo de defectos cromosómicos y complicaciones asociadas al embarazo. España 2005; Vol. 19: 106-117.
Priore G. Marcadores bioquímicos del diagnóstico prenatal. Arch Gin Obstest, 2008; Vol. 46(1).
LotharT. Clinical Laboratory Diagnostics: Use and assessment of clinical laboratory results, English edition, 1998.
Jacobs D.S., Demott W.R. Grady H. et al., Laboratory Test Handbook, Edit by Lexi-Comp Inc. Cleveland, United States of America, 4th edition, 1996.
Tietz N. W. Clinical Guide to Laboratory test, edited by W.B. Saunders Company, third edition, United States of America ,1995.
Burtis C. and Ashwood E. Tietz Textbook of Clinical Chemestry, W.B. Saunders Company, third edition, United States of America,1999.
Dufour R. Clinical Use of Laboratory Data. A practical guide, Lippincott Williams&Wilkins, USA,1998. Lockitch G. Handbook of Diagnostic Biochemistry and Hematology in Normal Pregnancy. CRC Press, Inc. United States of America, 1993.
Wu J. and Nakamura R. Human Circulating tumor markers. Current Concepts and Clinical Applications. American Society of Clinical Pathologists, Chicago, 1997.
0 notes
Text
Trisomía 21 (Síndrome de Down)
BQD. Larissa Franco Monroy
Químico Analista de LV Laboratorios Clínico.
La trisomía 21, también llamado Síndrome de Down (SD), es la causa más frecuente de retraso mental identificable de origen genético. Se trata de una anomalía cromosómica que tiene una incidencia de 1 de cada 800 nacidos, y que aumenta con la edad materna. Es la alteración cromosómica más frecuente y mejor conocida.

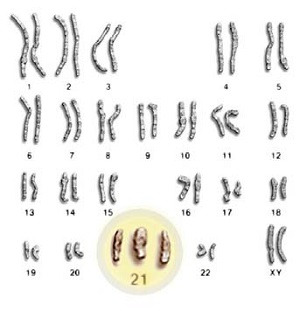
Los rasgos físicos y los problemas médicos asociados al síndrome de Down varían considerablemente de un niño a otro. Mientras que algunos niños con síndrome de Down necesitan mucha atención médica, otros llevan vidas sanas.
A pesar de que el síndrome de Down no se puede prevenir, se puede detectar antes del nacimiento. Los problemas de salud que pueden acompañar a este síndrome tienen tratamiento y hay muchos recursos, disponibles para ayudar tanto a los niños afectados por esta anomalía como a sus familias.
Normalmente, en el momento de la concepción, un bebé hereda información genética de sus padres en la forma de 46 cromosomas: 23 de la madre y 23 del padre. Sin embargo, en la mayoría de los casos de síndrome de Down el niño hereda un cromosoma de más, el nº 21, teniendo un total de 47 cromosomas en vez de 46. Es este material genético de más el que provoca los rasgos físicos y los retrasos evolutivos asociadas al síndrome de Down.
Valoración clínica.
Valoración prenatal para su detección
Tamizaje sérico materno
Con tamizaje nos referimos a la determinación en sangre de ciertas hormonas, las cuales al encontrarse en niveles anormales con cifras elevadas, sugieren alta probabilidad de que el niño nazca con alguna alteración genética; estas hormonas son la alfa feto proteína, el estriol no conjugado y la gonadotropina coriónica humana, que en conjunto se conocen como “Triple Marcador” al que recientemente se añadió la determinación de inhibina, por lo que en algunos laboratorios ya disponemos del “Cuádruple Marcador” con lo cual aumenta la sensibilidad y especificidad de la prueba.
Estas pruebas se pueden realizar entre la semana 15 y 18 de edad gestacional y el resultado se coteja con la edad materna. El resultado del promedio nos orientará sobre la probabilidad de que el producto presente al nacimiento alguna alteración genética, lo que obligaría a realizar más estudios, sin embargo, el estudio solo tiene el 60% de eficacia, con una probabilidad del 5% de dar resultados incorrectos por lo que su utilidad es limitada.
Valoración dirigida
El ultrasonido, realizado por manos expertas, aumenta la sensibilidad del triple marcador del 60 a 74%, buscando alteraciones estructurales del feto, como son la ausencia del hueso nasal, presencia de pliegue nucal, el perímetro cefálico y la longitud del fémur menor al esperado para la edad gestacional.
Recién nacidos
Durante la valoración inicial del recién nacido y en etapas posteriores de la vida, la presencia de ciertos rasgos pueden sugerir la presencia del síndrome, los cuales por si mismos no hacen el diagnóstico, sólo nos orientan a la posibilidad de su presencia, por lo que el pediatra deberá valorar cada caso individualmente. El diagnóstico definitivo siempre será con la determinación del cariotipo en sangre, lo cual no dará información valiosa sobre el mecanismo por el cual se presentó la trisomía y así poder proporcionar asesoría genética a los padres sobre futuros embarazos.
Información para Para médicos:
La trisomía 21, también llamado Síndrome de Down (SD), es la causa más frecuente de retraso mental identificable de origen genético. Se trata de una anomalía cromosómica que tiene una incidencia de 1 de cada 800 nacidos, y que aumenta con la edad materna. Es la cromosomopatía más frecuente y mejor conocida.
Etiología
El Síndrome de Down es también conocido como trisomía del par 21 debido a una alteración genética producida por la presencia de un cromosoma extra en dicho par, producto de:
Falta de disyunción en la meiosis, dando como resultado a dos células hijas completamente anormales, una de las cuales portaría 24 cromosomas y la otra 22, en lugar de 23 cromosomas como correspondería. Si la célula portadora de 24 cromosomas es fecundada por un gameto haploide, el resultado sería un individuo con 47 cromosomas (trisomía) y en el caso de que la célula portadora de 22 cromosomas sea fecundada el individuo presentaría 45 cromosomas (monosomía).
Falta de disyunción en la mitosis, durante las primeras divisiones celulares de una célula embrionaria, generando un mosaicismo que se caracteriza por dos tipos de poblaciones celulares distintas a nivel cromosómico. Una población presentaría un número anómalo de cromosomas y la otra un número normal, sus características varían de acuerdo a la proporción y ubicación de estas células anormales.
Translocación desequilibrada, en la que en muchos casos un cromosoma sufre de una rotura a nivel estructural, dando como resultado un fragmento cromosómico libre, que llega a acoplarse a otro par de cromosomas ocasionando así una trisomía.
El 95 % de los casos tienen una predisposición materna, donde la edad de la madre juega un papel importante ya que la incidencia de la alteración genética aumenta a partir de los 45 años, debido a que la mujer nace con una dotación establecida de ovocitos, siendo éstos susceptibles a la atresia e influencias ambientales de carácter nocivo que llegan a modificar genéticamente su estructura.
Aproximadamente el 4% de los casos se debe a una traslocación desequilibrada entre el cromosoma 21 y los cromosomas 13 ,14 o 15, donde y el 1% restante se debe a mosaicismo ocasionado por la no disyunción del cromosoma 21, cabe resaltar que en la translocación desequilibrada y el mosaicismo la edad materna carece de importancia debido a que estos dos procesos se originan a nivel embrionario.
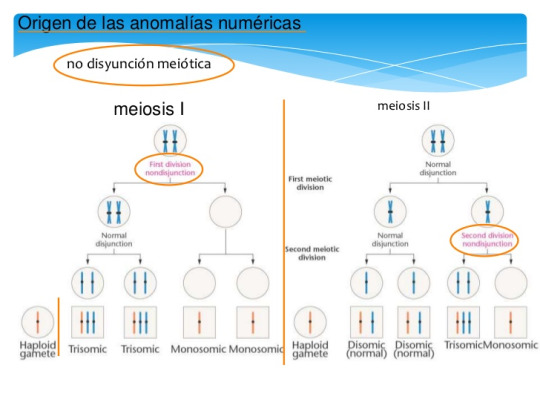

Cuadro Clínico
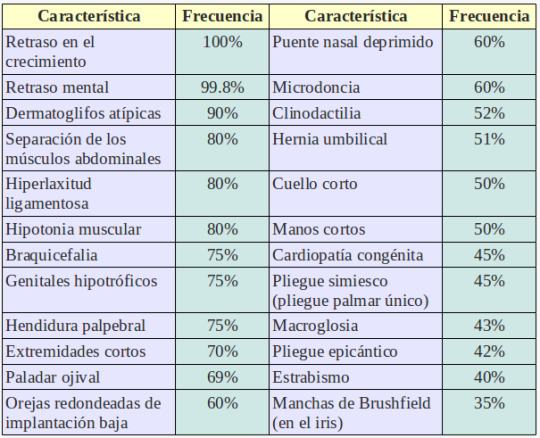
Valoración clínica
Hay dos tipos de pruebas prenatales que se utilizan para detectar el síndrome de Down en un feto: las pruebas de cribado y las pruebas diagnósticas. Las pruebas de cribado estiman el riesgo de que un feto tenga el síndrome de Down; las pruebas diagnósticas permiten afirmar o negar si el feto padece efectivamente esta anomalía.
Entre las pruebas de cribado, se incluyen las siguientes:
Prueba de la translucencia nucal. Esta prueba, que se realiza entre las semanas 11 y 14 de embarazo, utiliza la ecografía para medir el grosor del pliegue nucal. (En bebés con síndrome de Down y otras anomalías cromosómicas se tiende a acumular fluido en esa parte, lo que hace que el pliegue sea más grueso.) Esta medida, junto con la edad de la madre y la edad gestacional del bebé, se puede utilizar para calcular las probabilidades de que el bebé tenga el síndrome de Down. La prueba se suele realizar junto con un análisis de la sangre materna.
El triple cribado o el cuádruple cribado (también conocidos por sus nombres en inglés: "triple screening" o "quadruple screening"). Estas pruebas miden las cantidades de diversas hormonas tales como la alfa feto proteína, el estriol no conjugado y la gonadotropina coriónica humana y determinación de inhibina, sustancias en la sangre materna. Generalmente se practican entre las semanas 15 y 18 de embarazo.
Ecografía de alta precisión. El ultrasonido, aumenta la sensibilidad del triple marcador del 60 a 74%, buscando alteraciones estructurales del feto, como son la ausencia del hueso nasal, presencia de pliegue nucal, el perímetro cefálico y la longitud del fémur menor al esperado para la edad gestacional.
Las pruebas diagnósticas incluyen:
Muestreo de vellosidades coriónicas. El muestreo de vellosidades coriónicas consiste en extraer una parte minúscula de la placenta, a través del cuello uterino o mediante una aguja que se introduce en el abdomen. La ventaja de esta prueba es que se puede practicar durante el primer trimestre de embarazo, típicamente entre las semanas 10 y 12. La desventaja es que se asocia a un riego ligeramente superior de aborto que la amniocentesis y presenta otras complicaciones.
Amniocentesis. Esta prueba, que se realiza entre las semanas 15 y 20 de embarazo, consiste en extraer una pequeña cantidad de líquido amniótico a través de una aguja que se introduce en el abdomen. Las células fetales extraídas se analizan para detectar posibles anomalías cromosómicas. La amniocentesis se asocia a un riesgo reducido de complicaciones, como el parto prematuro y el aborto.
Muestreo percutáneo de sangre umbilical. Habitualmente se realiza a partir de la semana 18 de embarazo. En esta prueba se utiliza una aguja para extraer una pequeña muestra de sangre del cordón umbilical. Se asocia a riesgos similares a los de la amniocentesis.
Referencias
1. López Morales P., López Pérez R., Parés Vidrio G., Borges Yañez A., Valdespino M. Reseña Histórica del síndrome de Down. Revista ADM 2000:57:5:193-199. URL disponible en:http://www.medigraphic.com/pdfs/adm/od-2000/od005g.pdf. Accedido el 17 de octubre de 2016.
2. Sadler, T.W. Lagman embriología médica: con orientación clínica. 10ma edición. Editorial: Médica Panamericana. Buenos aires -argentina. 2008: 17-20.
3. Artigas. L.M. Síndrome de Down (trisomía 21). 37-43. URL. Disponible en:http://www.aeped.es/sites/default/files/documentos/6-down.pdf38. Accedido el 17 de octubre de 2016.
4. Fernández, M, P. Síndrome de Down. Alteraciones anatómicas y fisiologías que repercuten en la comunicación, lenguaje y el habla. Programa de intervención logopedia. 2011. URL disponible en: http://www.csi-csif.es/andalucia/modules/mod_ense/revista/pdf/Numero_43/PILAR_FERN ANDEZ_MARTINEZ_1 .pdf. Accedido el 17 de octubre 2016.
5. Martínez F. Bermejo S. Rodríguez P. Diagnóstico clínico del síndrome de Down basado en 11 rasgos. Análisis epidemiológico de la especificidad de los rasgos estudiados. URL: disponible en: https://www.aeped.es/sites/default/file s/anales/45-5-16.pdf. Accedido el 18 de octubre 2016.
1 note
·
View note
Text
ARTRITIS REUMATOIDE UNA ENFERMEDAD AUTOINMUNE MULTIFACTORIAL (Clínica y Diagnóstico).
Oct 12th, 2016 3:07:00pm
QFB Filadelfo Mendoza Noloya
Químico Analista de LV Laboratorios Clínico.
La artritis reumatoide (AR) es la más frecuente de las enfermedades reumáticas inflamatorias crónicas. Al igual que muchas enfermedades autoinmunitarias es multifactorial, es decir, involucra factores ambientales, genéticos, inmunológicos, psicológicos y endocrinos. El diagnóstico de AR puede ser difícil de establecer. Se basa en la comparación entre manifestaciones clínicas y pruebas de laboratorio (autoanticuerpos, parámetros biológicos de inflamación). El manejo adecuado y temprano mejora la evolución y pronóstico de la enfermedad. El seguimiento continuo y periódico de la patología es una herramienta indispensable para evaluar el progreso de la enfermedad y hacer ajustes en el manejo terapéutico.
Los estudios bioquímicos basales en el paciente con diagnostico de artritis reumatoide deben incluir: Biometría Hemática, Reactantes de fase aguda (Velocidad de Sedimentación Globular, Factor Reumatoide, Proteína C Reactiva) Transaminasas, Fosfatasa Alcalina, Creatinina y Examen General de Orina, Antiestreptolisisnas O (ASO) para cuando se sospecha que el paciente puede padecer reuma articular agudo o glomerulonefritis aguda, una patología que afecta el funcionamiento del riñón).
La elevación de la VSG y PCR tiene estrecha relación con la actividad inflamatoria de la enfermedad.
Tasa de Sedimentación de Eritrocitos / Velocidad de Sedimentación Globular (VSG). La tasa de sedimentación de eritrocitos mide cuán rápido los eritrocitos (glóbulos rojos de la sangre) caen al fondo de un tubo de ensayo. Se calcula midiendo la distancia en que la sangre sedimenta en una hora.
La tasa de sedimentación se usa para indicar inflamación, ya que sustancias inflamatorias en la sangre hace que los eritrocitos se junten causando aglutinaciones que se vuelven más pesadas y caen más pronto que una célula individual.
Esta prueba tiende a medir la cantidad de inflamación presente, una tasa de sedimentación alta significa mucha inflamación. Puede ayudar al médico a distinguir entre un padecimiento inflamatorio de uno que no lo es.
Puede determinar si la inflamación está aumentando o disminuyendo. Si no hay inflamación, la tasa de sedimentación es comúnmente menor a 20 mm por hora. Los valores normales (por el método Westergren) para adultos son los siguientes:
Hombres menores de 50 años: menos de 15 mm/h.
Hombres mayores de 50 años: menos de 20 mm/h.
Mujeres menores de 50 años: menos de 20 mm/h.
Mujeres mayores de 50 años: menos de 30 mm/h.
Proteína C-reactiva (PCR). Esta prueba también mide la cantidad de inflamación presente.
Los niveles de PCR responden más rápidamente a los cambios en la actividad inflamatoria que la velocidad de eritrosedimentación.
La PCR probablemente sea una medición precoz de la inflamación más sensible que la velocidad de eritrosedimentación.
Mientras que sólo se necesita una hora y muy poco equipo para realizar el análisis de la velocidad de eritrosedimentación, la determinación de la proteína C reactiva lleva un día y exige más equipo.

El Factor Reumatoide (FR) es una prueba serológica inmunológica. Esta prueba a menudo (70 al 80%) es positiva en personas con artritis reumatoide. Un resultado de más de 40 UI pudiera considerarse anormal, los resultados pueden llegar hasta las 2000 UI o más, o pueden expresarse con un número menor indicando la dilución de la sangre a la cual se midió el Factor Reumatoide (titulación).
Los análisis pueden ser negativos durante los primeros meses, haciendo la prueba menos útil para el diagnóstico temprano. Estos factores también existen en pacientes que no presentan ninguna enfermedad y en pacientes con otras enfermedades, pero con menor frecuencia que en los que padecen Artritis Reumatoide.
El Factor Reumatoide a veces puede indicar la actividad de la enfermedad, cuando el número es alto, la enfermedad es más activa y cuando es bajo lo es menos, aunque el Factor Reumatoide no es específico de la artritis, puede elevarse debido a una infección, gripe, etc.
El Factor Reumatoide en algunos casos puede resultar negativo aunque la persona tenga Artritis Reumatoide, a esto se le llama AR seronegativa.
La Artritis Reumatoide nunca se diagnostica basándose únicamente en este análisis. Un resultado positivo en conjunción con un examen físico (y tantos otros análisis como sean necesarios), que apuntan hacia la Artritis Reumatoide puede ayudar a hacer el diagnóstico.
Los Anticuerpos Anti Péptido Cíclico Citrulinado (anti-CCP) tiene un cociente de de probabilidad para el diagnostico de artritis. Su aparición puede preceder con tiempo a la enfermedad.
Esta prueba que sirve para confirmar el diagnóstico de artritis reumatoide. El anticuerpo anti-péptido cíclico citrulinado (Anti-CCP) frecuentemente se analiza en combinación con el factor reumatoide mediante una muestra de sangre.
Analizar ambos puede ayudar a establecer y confirmar el diagnóstico correcto ya que la combinación de estas pruebas tiene casi un 100% de valor predictivo positivo de que el paciente tiene Artritis Reumatoide. Además, el anti-CCP también puede ayudar a indicar cómo le afectará la enfermedad o predecir la necesidad de una terapia más agresiva.
Los resultados negativos no descartan la artritis, pero puede ser que tenga otro tipo de enfermedad reumática similar a la Artritis Reumatoide.
Referencias:
ϖ B. Combe , C. Lukas, J. Morel, Artritis reumatoide del adulto: epidemiología, clínica y diagnóstico. EMC - Aparato Locomotor, Volumen 48, Issue 4, December 2015, Pages 1–17.
ϖ Martha Lucía González Arboleda Jorge Rueda Gutiérrez et al. Utilidad diagnóstica del anticuerpo antipéptido cíclico citrulinado como prueba diagnóstica en pacientes con artritis reumatoide. Revista Colombiana de Reumatología, Volumen 20, Issue 1, March 2013, Pages 9-18.
0 notes
Text
Reseña Histórica de un Laboratorio Clínico.
Oct 5th, 2016
QFB Francisco Bravo Alemán
Jefe de LV Laboratorios Clínicos
En LV Laboratorios tenemos la fortuna de participar en el cuidado de su salud desde hace 40 años; con ustedes compartimos el mundial de México, aplaudimos a figuras como Nacho Calderón y Enrique Borja, experimentamos la eliminación en el 86 por parte de Alemania y coincidimos que “no era penal” en Brasil 2014.
Hemos compartido la visita de Papas y participado en la vida cotidiana de nuestro país. A lo largo de estos 40 Años hemos y seguimos evolucionado en metodologías, nuevos exámenes y uso de nuevas tecnologías automatizadas por lo que quisimos compartir esta reseña histórica de la Medicina relacionada al laboratorio clínico con ustedes que nos favorecen con su confianza.
Los primeros antecedentes clínicos provienen de los antiguos griegos quienes basados en su teoría de los 4 elementos (tierra, agua, viento y fuego) proponen un análisis físico de la orina, la saliva y flema de una persona como indicativo de la conservación o perdida de la salud. La caída de Roma trajo una obscura época para el desarrollo médico durante toda la época medieval, donde científicos y médicos eran sometidos a la hoguera por estudiar el cuerpo humano (Andres Vesalius).
En el Renacimiento, el descubrimiento de América y de la Conquista, los traumas de guerra y diseminación de epidemias como la viruela y sífilis; introducidas por los invasores redujeron la población en un 40 % en un lapso de menos de 80 años. Los avances de la medicina europea durante los siglos XVII, XVIII, y XIX (respaldados por la medicina árabe) favorecieron el bienestar social en el viejo continente en tanto que las colonias inglesas e hispanoamericanas se veían involucrados en luchas independentistas y revolucionarias.
Leeuwenhoek (1673) y su Microscopio; Jenner (1797) y su vacunación contra la viruela; Virchow (1858) con sus notas sobre la estructura celular; Lister (1866) y sus conceptos de desinfección y antisepsia; Pasteur (1895) con sus notables investigaciones en Microbiología; Koch (1910) y sus inmortales postulados microbiológicos en la transmisión de una infección; así como numerosos médicos e investigadores sentaron los fundamentos científicos.
Los primeros laboratorios clínicos surgen hace más de 200 años en Inglaterra y Francia con la adaptación de pabellones o pequeñas habitaciones en los hospitales para participar en el diagnóstico de los enfermos. Las pruebas rudimentarias eran sencillas y necesitaban pocos instrumentos.
Al inicio del siglo XX se extendió el uso de la jeringa hipodérmica de vidrio esmerilado para administrar algunos medicamentos y obtener espécimenes de sangre. La punción venosa facilitó y estimuló los estudios químicos en sangre humana. En Microbiología la inmortal caja de Petri; los caldos, agares y medios de cultivo como el Tood-Hewitt, Simonss, Mc Conkey, Lowentein-Jensen Sabouraud y sobretodo la prueba de sensibilidad a los antibióticos desarrollada por Kirby-Bauer; favorecieron el diagnóstico y el tratamiento de las diferentes enfermedades infecciosas que padece el ser humano.
A partir de 1940, los avances prodigiosos en las técnicas instrumentales, como la cromatografía, la ultracentrifugación y la electroforesis; y métodos ópticos como la fotometría de llama, la refractometría y la fluorimetría, encontraron valiosa aplicación en los laboratorios clínicos. El desarrollo del estudio de las enzimas metabólicas (Hígado, Páncreas, étc), favoreció el desarrollo de marcas históricas como Klett, IL Intrumentation, Carl Zeiss y sus excelentes microscopios; Clay Adams y sus contadores de células; equipos y fabricantes que perduran hasta la fecha.
Los primeros laboratorios semejaban una cocina casera, ya que en ellos una estufa Across era indispensable para catalizar reacciones dependiente de la ebullición; Nombres como Folin Wu (determinación de glucosa), Benedict (azúcares reductores), Diacetil Monoxima (determinación de urea), la determinación de Bilirrubinas por el método de Jendrassik-Gróf se volvieron cotidianos. En coagulación Quick desarrollo lo que hoy se conoce como el Tiempo de Protombina, Ivy y su tiempo de sangrado; En Hematología, Wintrobe diseña sus tubos para realizar pruebas tan básicas y necesarias como el Hematocrito y la Velocidad de Sedimentación Globular (VSG); Shalli fabrica su pipeta para la determinación de Hemoglobina utilizando la Solución de Drabkin con Cianuro y Ferriciuanuro de Potasio para cuantificar la Hemoglobina en sangre; Thoma confecciona sus micropipetas de vidrio para conteo de Eritrocitos, Leucocitos y Plaquetas. La Bioquímica Clínica se convierte en todo un arte manual para la obtención de resultados confiables.
Muchísimos investigadores más aportaron su talento y dedicación para el desarrollo científico de un Laboratorio clínico. Se forman las primeras asociaciones de profesionales interesados en la profesionalización de los Laboratorios Clínicos; surgen las primeras revistas especializadas como la Clinical Chemistry. Y en 1945, un grupo de profesionales del laboratorio clínico de la ciudad de Filadelfia, decidieron comparar los resultados obtenidos a partir de una misma muestra distribuida de manera anónima; los valores obtenidos fueron tan sorprendentes que se publicaron los primeros estudios y por las expectativas creadas deciden fundar el Colegio de Biopatólogos de Estados Unidos que organizó desde entonces el primer servicio de evaluación externa de calidad.
En 1950, Levey y Jennings aplicaron por primera vez en los procedimientos estadísticos de los laboratorios clínicos, gráficas de control de calidad que hoy día siguen vigentes y que permiten conocer si los resultados alcanzan el nivel de confiabilidad o no.
Los años 70 s´setenta cuando predominaba la música disco, John Travolta y los Bee Gees; se caracteriza por la creación de laboratorios mas formales con secciones independientes física y organizacional, con personal y materiales exclusivos. Surge así la necesidad de más profesionales con conocimientos en análisis clínicos iniciando el control de calidad interno, propio laboratorio mediante una mezcla (pool) de los sueros obtenidos de los propios pacientes normales de un mismo laboratorio.
Los años 80 s´ con pleno auge de Madonna y Michael Jackson, y toda América tarareando las melodías del grupo Menudo; se caracterizan por la aparición y posterior consolidación de los sistemas automatizados, se observa un marcando un avance de las técnicas instrumentales. La automatización, facilito al laboratorio, atender a un número cada vez mayor de solicitudes, y controlar mejor todas las etapas analíticas, obtener alta precisión, procesar muchas muestras en poco tiempo y utilizar bajos volúmenes de muestras y reactivos; aparece la estandarizaron los métodos; la estadística mediante gráficos de Levy-Jennings y las reglas de Westgard mejoran la reproducibilidad y exactitud en el Laboratorio Clínico.
La década de los noventa, donde bailamos sin parar las coreografías de los Backstreet Boys y The New Kids on the Block (NKTB) viene marcada por la aparición de los auto analizadores de inmunoanálisis (Inmunologia Hormonal); donde la aplicación de la robótica, desarrollo de la Biología Molecular y la Informática Clínica favorecen el despegue de el Laboratorio.
En este nuevo Siglo, el crecimiento y control de un Laboratorio Clínico se ha enfocado hacia el cumplimiento de normas internacionales ISO (International Standarization Organization) con énfasis en la documentación y la necesidad de la mejora continua hacia la satisfacción del cliente; desde el año 1994 el propósito central de la familia de normas ISO 9000:2000 es favorecer la implementación y operación de sistemas de gestión de la calidad eficaces en las decisiones clínicas.
En esta sociedad mexicana, cada día mejor informada está también más clara que la calidad de los servicios de salud está directamente relacionada con la eficacia de la atención a partir de la publicación de la norma NOM-166-SSA1-1997 donde la organización y funcionamiento de los laboratorios la operación legal de un laboratorio dependerá del cumplimiento cabal de los preceptos allí enmarcados.
Los objetivos que persigue esta norma obligatoria, es lograr que los Laboratorios Clínicos Mexicanos establezcan programas de aseguramiento de la calidad que permitan brindar al paciente un máximo beneficio, asegurar que los resultados analíticos contribuyan positivamente en las decisiones clínicas, incrementar de forma sistemática la confiabilidad de los resultados, y detectar oportunamente las desviaciones que son responsabilidad del laboratorio para que se eviten y se reduzcan al mínimo.
La NOM-166-SSA1-1997, obligatoria en todo el país, establece las medidas a seguir para que estos servicios sean de calidad y eficiencia, se deben implementar controles de calidad tanto internos como externos que sirvan para evaluar de manera general el servicio otorgado. Del numeral 15 de esta norma se desprende que los laboratorios deberán contar con procesos que aseguren la calidad de los resultados. Por lo anterior, cualquier laboratorio privados o público, deberán de dar cumplimiento a la Norma 166-SSA1-1997, y contar con manuales que incluyan: manual de organización, manual de procedimientos administrativos, manual de métodos analíticos en cada departamento para cada prueba, bitácoras de mantenimiento y calibración de equipos, guía para toma transporte de muestras, manual de seguridad e higiene y manual de aseguramiento de la calidad.
La Norma Oficial Mexicana hace referencia a cuatro normas adicionales en las que se establecen otros requisitos que debe cumplir el personal del laboratorio, el cual deberá adoptar las medidas preventivas para su protección en el almacenamiento, transporte y manejo de substancias tóxicas, e infecciosas; tomando en cuenta los requisitos que señalen las disposiciones generales aplicables en la materia, en particular las normas oficiales mexicanas NOM-087-ECOL-1995, NOM-009-STPS-1993, NOM-012-STPS-1993 y NOM-114-STPS1994. Finalmente es importante mencionar que las especificaciones de estas normas corresponden de un modo conceptual con los requisitos más importantes de las normas ISO.
Hoy día la norma meta, la norma objetivo de cualquier Laboratorio clínico es cumplir la Norma ISO 15189:2003 para alcanzar la acreditación del Laboratorio Clínico. Esta es una norma de acreditación de ámbito internacional, que por su contenido y redacción es una norma completa, minuciosa y con un alto nivel de exigencia. Define perfectamente las actividades del laboratorio clínico y los requisitos particulares de calidad y competencia de un Laboratorio Clínico cubre todas las pruebas y establece indicaciones para cualquier procedimiento de un Laboratorio con el fin de asegurar su calidad, es aplicable a todas las disciplinas de los servicios de laboratorio clínico y a los sistemas de calidad administrativos y técnicos que participan en el funcionamiento de los laboratorios clínicos, se basa en las normas ISO 17025:1999 e ISO 9001:2000.
La ISO 15189 es apropiada para las fases preanalítica y postanalítica, para los procedimientos no normalizados y desarrollados por el laboratorio, y para las propiedades con valores subjetivos como las descripciones de los grupos sanguíneos o las preparaciones histológicas; aspectos importantes en el laboratorio clínico. En conjunto la norma 15189 incluye dos apartados indispensables: los requisitos necesarios para la acreditación, y las competencias requeridas a los profesionales de laboratorio que participan en la operación, para asegurar la confiabilidad y la correcta interpretación de resultados.
En LV sabemos que tratamos con personas preocupadas por su salud; estamos involucrados en el cuidado del medio Ambiente mediante el cumplimiento de las normas Ecológicas vigentes; crecemos en el uso de nuevas pruebas y tecnologías, mejoramos nuestras propuestas comerciales, escuchamos a nuestros médicos y sus necesidades; pero sobretodo, continuamos reforzando nuestros valores de toda la vida: ÉTICA, RESPONSABILIDAD, PROFESIONALISMO, CONFIDENCIALIDAD Y CALIDEZ HUMANA A NUESTROS PACIENTES.

Contador de colonias bacterias.

Espectrofotómetro Carl Zeiss.

Contador de células sanguíneas.

Balanza Granataria Ohaus de plato doble.
0 notes
Text
Relación Insulina-Glucagón
en el Metabolismo de la Glucosa
QFB Francisco Bravo Aleman. Jefe de LV Laboratorios Clínicos
El Páncreas se encuentra compuesto principalmente por dos tipos de tejidos, los Acinos cuya función es secretar jugos digestivos que posteriormente se liberaran en el intestino, y los Islotes de Langerhans que a través de su secreción endocrina liberan insulina y glucagón hacia la sangre. Las células Alfa y Beta de los islotes de Langerhans secretan glucagón e insulina. La insulina es una hormona de origen proteico que realiza efectos diversos sobre el transporte de los metabolitos.
• A nivel muscular y adiposo esta hormona aumenta la permeabilidad de la membrana para facilitar el ingreso de glucosa, aminoácidos, nucleótidos y fosfato a la células, aunque el hígado y tejido nervioso son permeables al ingreso de glucosa; y durante la actividad física, no se hace necesaria la presencia de insulina para permitir el ingreso de los nutrientes a través de la membrana en los tejidos.
• A nivel de carbohidratos, la insulina aumenta el transporte de glucosa al interior celular produciendo una disminución de los valores de glucosa en sangre, promueve la glucógeno génesis (almacenamiento de glucosa como glucógeno).
•A nivel de ácidos grasos, la insulina favorece su almacenamiento en el tejido adiposo, disminuyendo la hidrólisis de los triglicéridos almacenados y la concentración de ácidos grasos libres en el plasma.
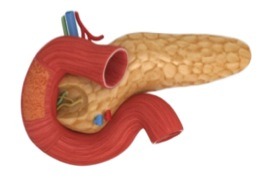
La insulina también ejerce sus efectos sobre el metabolismo de las proteínas, aumenta el transporte de aminoácidos al interior de la célula, disminuyendo el catabolismo de las proteínas; por lo que aparentemente promueve el crecimiento celular.

Cuando las concentraciones de glucosa en sangre (90-110 mg por cada dl o 100 ml) aumentan más de dos a tres veces de lo normal, se incrementa diez veces la secreción de insulina en un plazo de tres a cinco minutos; posterior a quince minutos aproximadamente la secreción de insulina aumenta aún más, no solamente por la descarga de insulina preformada, sino también nueva hormona sintetizada por algún sistema enzimático. De la misma forma en que la insulina aumenta con rapidez frente al incremento de la glucemia y se observa un rápido descenso cuando los niveles de glucosa en sangre retornan a sus valores normales.

El GLUCAGON es una hormona complementaria en la regulación de la concentración de glucosa sanguínea. Cuando los niveles de glucosa aumentan, se produce una inhibición en la secreción de glucagón y un aumento en la secreción de insulina, mientras que cuando la glucemia disminuye aumenta la secreción de glucagón y disminuye la de insulina respectivamente.
• A nivel de carbohidratos, el glucagón promueve la glucogenólisis y la neoglucogénesis a partir de amino ácidos en el hígado, ya que estos dos procesos generan un aumento de los niveles de glucosa disponibles para el organismo.
• A nivel de lípidos promueve el desdoblamiento de triglicéridos y un aumento de la concentración de ácidos grasos en sangre.
Por lo anterior, se puede decir que el hígado constituye un "sistema amortiguador de la glucemia" ya que al aumentar los niveles de glucosa en sangre, esta se almacena inmediatamente por acción de la insulina (excepto en los tejidos mencionados), por lo que la glucemia disminuye. Posteriormente cuando los niveles de glucosa y de insulina se encuentran ya disminuidos, se produce un aumento en la liberación de glucosa hacia la sangre desde el hígado por la acción glucógenolítica del glucagón hasta que la glucemia retorna a sus valores normales.

Los niveles de glucosa deben mantenerse constantes ya que la disminución de la glucemia afectaría particularmente al cerebro, la retina y células epiteliales germinativas ya que estos utilizan la glucosa como nutriente para abastecerse energéticamente.
Por lo contrario, si los niveles de glucosa en sangre fueran muy altos (hiperglucemia), se produciría un incremento en la deshidratación celular por el efecto osmótico de la glucosa en la sangre; un aumento en la pérdida de glucosa por orina y a consecuencia de ello una disminución de los líquidos y electrolitos en el organismo por un mecanismo de diuresis osmótica provocada a nivel del riñón.
Concluyendo, la regulación del metabolismo de la glucosa es una compleja interacción de diferentes hormonas que también incluyen al cortisol, la adrenalina y otras hormonas digestivas (gastrina, secretina, colecistocinina, etc.).

0 notes
Text
El factor de necrosis tumoral alfa y su utilidad diagnóstica en infecciones bacterianas
QFB Magaly Alcocer Medina
Químico Analísta de LV Laboratorios Clínicos
PARA PÚBLICO EN GENERAL
El factor de necrosis tumoral (TNF-α por sus siglas en inglés), es una proteína de nuestro organismo que se produce por una agresión de origen bacteriano, alguna enfermedad autoinmune como la artritis reumatoide, enfermedades coronarias, entre otras. Esta proteína, nombrada como citocina o citoquina, es producida por una gran variedad de células de nuestro cuerpo.
Las bacterias en su estructura, cuentan con una molécula conocida como lipopolisacárido (LPS) que, al entrar a nuestro organismo, todas nuestras células la reconocen e inmediatamente realizan complejos procesos como mecanismo de defensa para anular dicho agente infeccioso.
La función general que realiza el TNF-α es de servir como amplificador de señales para que nuestro sistema de defensa actúe con mecanismos que incluyen reactantes para matar al microorganismo perjudicial.
Hoy en día existen muchos datos clínicos para saber si una persona padece una infección bacteriana con riesgo a convertirse en sepsis. En un paciente hospitalizado por alguna enfermedad, o recién nacidos, que tienen un sistema inmunológico incapaz de neutralizar el ataque bacteriano, es muy fácil que una infección no controlada y tratada pueda convertirse en sepsis.
Una de las desventajas de una infección bacteriana no tratada, es que tienen en común síntomas y signos de otras enfermedades que no son de origen bacteriano. Es ahí donde el TNF-α cumple un rol importante al momento de establecer el diagnóstico sobre la etiología de la enfermedad. A pesar de que este reactante de fase aguda se eleva en diferentes patologías, se ha demostrado que presenta una elevación importante en las infecciones bacterianas severas, lo que hace al TNF-α un marcador viable para establecer el diagnóstico y seguimiento de la sepsis, infecciones bacterianas severas o shock séptico, junto a otras pruebas de laboratorio, en ayuda al médico y monitoreo del paciente.
Las pruebas que ofrecen los laboratorios clínicos para diagnóstico y seguimiento de una infección bacteriana severa y/o sepsis son:
Biometría hemática completa
Procalcitonina
Proteína C reactiva
Cultivo de sangre (hemocultivo)
Química Sanguínea
TNF-α, Interleucinas 1, 6, 8 y 10
Gasometría venosa
Dímero D y tiempos de coagulación
Estos estudios van enfocados al apoyo al diagnóstico clínico, historial clínico y seguimiento de sepsis, shock séptico, infecciones bacterianas severas, para elegir el tratamiento oportuno y así poder combatir de forma efectiva el problema de salud.
Referencias bibliográficas:
Falfán, R. Factor de necrosis tumoral: actividad biológica en neumopatías intersticiales; Rev. Instituto Nacional de Enfermedades Respiratorias, México, 15(1),2002; p. 48-53.
Sánchez, A.; Sánchez, A. Marcadores humorales en la sepsis severa; Rev. Cubana de Medicina Intensiva y Emergencia: Cuba, 4(4),2005.
Prambudi; R.; Nani, D.; Warsono, Y. W.; Eryati, D. Tumor necrosis factor-alpha and interleukin-6 in early-onset neonatal sepsis; Paediatrica Indonesia, Indonesia: 56(1),2016; p. 15-18.
PARA MÉDICOS
El Factor de Necrosis Tumoral alfa (TNF-α por sus siglas en inglés) adquirió su nombre cuando fue descubierto en el suero de ratones tratados con lipopolisacáridos para el tratamiento de tumores. Este mediador causaba hemorragia en ellos y la consiguiente necrosis y regresión de estos tumores trasplantados. Bioquímicamente hablando el TNF-α es una proteína secretada por las células linfoides, monocitos y macrófagos activados siendo estos últimos la fuente principal de producción.
El TNF-α se activa como respuesta a un daño tisular o una infección, por eso también se le conoce como citocina proinflamatoria, como ya se mencionó los macrófagos son su principal fuente de producción, y se activan por los lipopolisacáridos que se encuentran en bacterias principalmente, promoviendo la transcripción aumentada del TNF-α. A esto se le suman los linfocitos B, células NK, mastocitos, células de Paneth, células de mesénquima intestinal, queratinocitos, células de la microglia, astrocitos, células del músculo liso y algunas células tumorales, así como células del epitelio intestinal. Además de todas las células que son capaces de producir esta citocina, el TNF-α induce su propia transcripción activando al factor nuclear-kB (NF-kB) y su propia regulación negativa con otros reguladores específicos como la interleucina 10 que por retroalimentación negativa suprime la liberación de TNF-α. El gen de esta citocina se encuentra en el brazo corto del cromosoma 6 junto con el complejo principal de histocompatibilidad.
La función del TNF-α en el cuerpo humano va desde regular la activación de los leucocitos para la liberación de diversas citosinas y quimiocinas hasta la producción de especies reactivas de oxígeno e intermediarios de nitrógeno. En un enfoque global, el TNF-α se encarga de regular la respuesta celular, proliferación, diferenciación, inflamación y apoptosis.
En la última década se han realizado bastantes estudios de diversas patologías en donde se encuentra implicado el TNF-α, de las cuales la mayoría son de origen infeccioso. Por citar algunas: malaria cerebral, choque séptico, leishmaniasis y lepra. Por otro lado, también se ha asociado a enfermedades autoinmunes.
El valor predictivo de mortalidad en pacientes con infección grave, ha tomado mayor importancia en los últimos años porque los estudios realizados demuestran una marcada elevación de esta citosina en sepsis, shock séptico y en fallo multiorgánico por lo que se ha propuesto como marcador temprano para la sepsis.
Un estudio realizado recientemente en el hospital Abdul Moeloek en Indonesia por la Universidad de Lampung para evidenciar la utilidad diagnóstica del TNF-α, consistió en evaluar a 52 neonatos de menor o igual a las 72 horas de edad que estaban divididos en dos grupos de estudio: los que presentaban datos de sepsis y los que no. El resultado arrojó valores elevados de TNF-α en los neonatos con sepsis a diferencia de los que no tenían sepsis y que presentaban signos y síntomas en común (figura 1)
Figura 1. Niveles de factor de necrosis tumoral en neonatos que no presentan sepsis (unproven), y en neonatos que presentan sepsis (proven).
Con base a lo realizado en este estudio, se puede comprobar el valor diagnóstico que tiene el TNF-α en una infección bacteriana, aunque este estudio haya sido realizado en casos de sepsis. Como ya se mencionó, el TNF-α está involucrado en muchos procesos, y no es específico para una enfermedad, pero junto a otros marcadores y pruebas diagnósticas, el uso de este marcador conlleva una ayuda útil para establecer diagnósticos de origen infeccioso.
Referencias bibliográficas
Falfán, R. Factor de necrosis tumoral: actividad biológica en neumopatías intersticiales; Rev. Instituto Nacional de Enfermedades Respiratorias, México, 15(1),2002; p. 48-53.
Sánchez, A.; Sánchez, A. Marcadores humorales en la sepsis severa; Rev. Cubana de Medicina Intensiva y Emergencia: Cuba, 4(4),2005.
Prambudi; R.; Nani, D.; Warsono, Y. W.; Eryati, D. Tumor necrosis factor-alpha and interleukin-6 in early-onset neonatal sepsis; Paediatrica Indonesia, Indonesia: 56(1),2016; p. 15-18.
0 notes
Text
Gasometría como apoyo en el diagnóstico de insuficiencia respiratoria y acidosis metabólica.
QFB Filadelfo Mendoza Noyola
Químico Análista en LV Laboratorios Clínicos
Para público en general:
La gasometría arterial (GSA) es la prueba que más rápida y eficazmente puede informar sobre el intercambio pulmonar de gases y el equilibrio ácido-base, siendo por ello una herramienta básica para el diagnóstico en problemas respiratorios. La indicación principal de la GSA es el diagnóstico, pronóstico y monitorización del tratamiento de la insuficiencia respiratoria.

La evaluación de la gasometría y del equilibrio acido básico sanguíneos es imprescindible para controlar la ventilación mecánica. Los métodos más utilizados son los que se basan en el análisis intermitente de muestras sanguíneas y en la medición continua de la pulsioximetría y capnografía y, con menos frecuencia, la gasometría invasiva continua.
En la parte de problemas de acidosis metabólica la importancia diagnostica, radica en la gasometría venosa ya que esta se evalúa el Lactato, el bicarbonato y el pH.

El ácido láctico es un producto terminal del metabolismo anaeróbico de la glucosa y se obtiene por reducción del ácido pirúvico en una reacción catalizada por la enzima deshidrogenasa láctica. En condiciones normales, los niveles séricos alcanzan las 2 mEq/L o menos, pero el ejercicio puede elevarlo hasta 4 mEq/L. La mayor parte del lactato se elimina de forma muy eficaz por el hígado y se utiliza en la gluconeogénesis o para la obtención de energía. Cuando se producen incrementos considerables de las cifras de lactato sérico con disminución del metabolismo de conversión de lactato a piruvato se instala un cuadro de acidosis metabólica a menudo grave que puede llevar al paciente a la muerte.
Aunque el diagnóstico definitivo de acidosis láctica sólo se confirma midiendo la concentración sanguínea de lactato, hay diversas características clínicas y de laboratorio que pueden dar indicios iniciales de la existencia de este trastorno.

Una manera práctica de guiar las investigaciones de laboratorio, se muestra a continuación:
• Gasometría. Ionograma (para determinar anión gap): Na - (HCO3 + Cl). Glucosa (hiperglicemia sugiere diabetes mellitus). Amoníaco (secundariamente elevado). Ácido láctico. Creatinina. Calcio. Pruebas de función hepática. Ácido úrico. Carnitina.
• Orina: Cetonas. pH, Sustancias reductoras, Ácidos orgánicos urinarios.
• Células sanguíneas: Anemia. Leucopenia. Trombocitopenia. (Pueden estar asociadas con acidurias orgánicas).
Referencias:
Carrillo Álvarez , Monitorización de la ventilación mecánica: gasometría y equilibrio acido básico. Anales de Pediatría, Volumen 59, Issue 3, 2003, Pages 252-259.
C. Lobete Prieto A. Medina Villanueva et al. Predicción del índice PaO2/FiO2 a partir del índice SpO2/FiO2ajustado por la medición transcutánea de CO2 en niños críticamente enfermos. Anales de Pediatría, Volumen 74, Issue 2, February 2011, Pages 91–96.
E. García Castillo, S. Sánchez-Cuéllar, et al. La gasometría arterial en el enfermo agudo y crónico respiratorio. Criterios de urgencia y gravedad. Medicine - Programa de Formación Médica Continuada Acreditado Volumen 11, Issue 63, October 2014, Pages 3782–3786.
Para médicos:
La gasometría arterial (GSA) es la prueba que más rápida y eficazmente puede informar sobre el intercambio pulmonar de gases y el equilibrio ácido-base, siendo por ello una herramienta básica para el diagnóstico en problemas respiratorios. La indicación principal de la GSA es el diagnóstico, pronóstico y monitorización del tratamiento de la insuficiencia respiratoria.
La evaluación de la gasometría y del equilibrio acido básico sanguíneos es imprescindible para controlar la ventilación mecánica. Los métodos más utilizados son los que se basan en el análisis intermitente de muestras sanguíneas y en la medición continua de la pulsioximetría y capnografía y, con menos frecuencia, la gasometría invasiva continua.
Los parámetros más útiles para valorar la oxigenación son la PaO2, saturación, relación entre la PaO2 y la fracción inspiratoria de oxígeno (PaO2/FiO2), índice de oxigenación, la PaCO2 para analizar ventilación y el pH y exceso de bases para valorar el equilibrio ácido básico. Se recomienda cuál debe ser la sistemática de interpretación de los valores obtenidos y se definen los distintos estados de acidosis y alcalosis.
En la parte de problemas de acidosis metabólica la importancia diagnostica, radica en la gasometría venosa ya que esta se evalúa el Lactato, el bicarbonato y el pH.
El ácido láctico es un producto terminal del metabolismo anaeróbico de la glucosa y se obtiene por reducción del ácido pirúvico en una reacción catalizada por la enzima deshidrogenasa láctica. En condiciones normales, los niveles séricos alcanzan las 2 mEq/L o menos, pero el ejercicio puede elevarlo hasta 4 mEq/L. La mayor parte del lactato se elimina de forma muy eficaz por el hígado y se utiliza en la gluconeogénesis o para la obtención de energía. Cuando se producen incrementos considerables de las cifras de lactato sérico con disminución del metabolismo de conversión de lactato a piruvato se instala un cuadro de acidosis metabólica a menudo grave que puede llevar al paciente a la muerte.
Aunque el diagnóstico definitivo de acidosis láctica sólo se confirma midiendo la concentración sanguínea de lactato, hay diversas características clínicas y de laboratorio que pueden dar indicios iniciales de la existencia de este trastorno.
El inicio repentino de hiperventilación e hipotensión en un paciente muy grave, la presencia de taquicardia, debilidad, náuseas y estupor son síntomas y signos clínicos inespecíficos que pueden ocurrir en quienes desarrollan una acidosis láctica.
Cuando la acidosis persiste y empeora, el paciente suele sufrir shock y muere si el proceso evoluciona sin tratamiento.
Los estudios iniciales de laboratorios revelan un aumento del resto de los aniones y por lo general un pH sanguíneo bajo, con disminución de los valores de bicarbonato sérico.
Estos 2 últimos signos ocurren en la medida en que no haya otro trastorno de ácidos y bases que compliquen el problema, como alcalosis respiratoria, que podría normalizar el pH sanguíneo o incluso tornarlo alcalino.
Una manera práctica de guiar las investigaciones de laboratorio, se muestra a continuación:
• Gasometría. Ionograma (para determinar anión gap): Na - (HCO3 + Cl). Glucosa (hiperglicemia sugiere diabetes mellitus). Amoníaco (secundariamente elevado). Ácido láctico. Creatinina. Calcio. Pruebas de función hepática. Ácido úrico. Carnitina.
• Orina: Cetonas. pH, Sustancias reductoras, Ácidos orgánicos urinarios.
• Células sanguíneas: Anemia. Leucopenia. Trombocitopenia. (Pueden estar asociadas con acidurias orgánicas).
Referencias:
Carrillo Álvarez , Monitorización de la ventilación mecánica: gasometría y equilibrio acido básico. Anales de Pediatría, Volumen 59, Issue 3, 2003, Pages 252-259.
C. Lobete Prieto A. Medina Villanueva et al. Predicción del índice PaO2/FiO2 a partir del índice SpO2/FiO2ajustado por la medición transcutánea de CO2 en niños críticamente enfermos. Anales de Pediatría, Volumen 74, Issue 2, February 2011, Pages 91–96.
E. García Castillo, S. Sánchez-Cuéllar, et al. La gasometría arterial en el enfermo agudo y crónico respiratorio. Criterios de urgencia y gravedad. Medicine - Programa de Formación Médica Continuada Acreditado Volumen 11, Issue 63, October 2014, Pages 3782–3786.
0 notes