#h2cro4
Photo
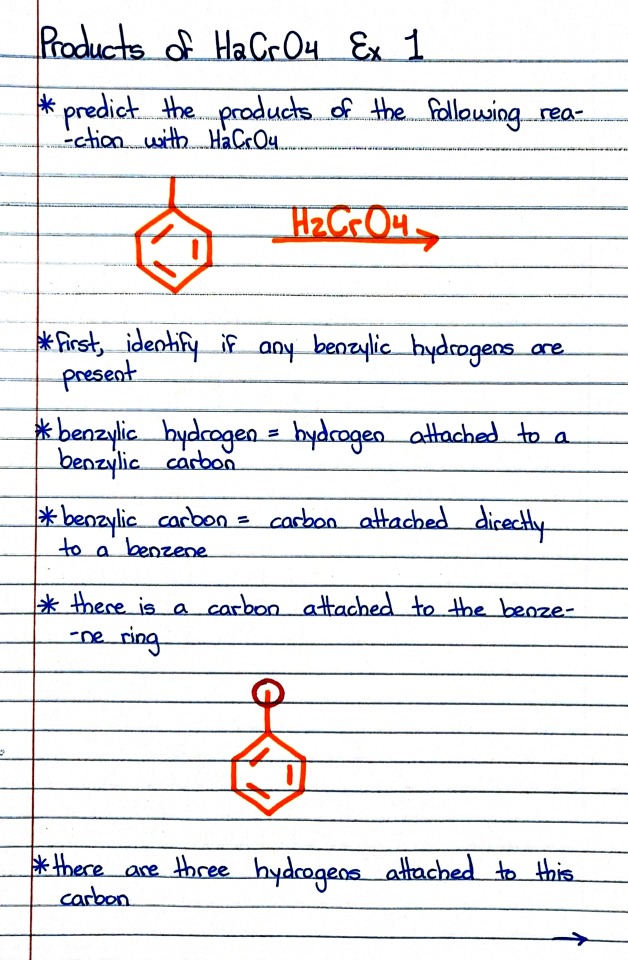
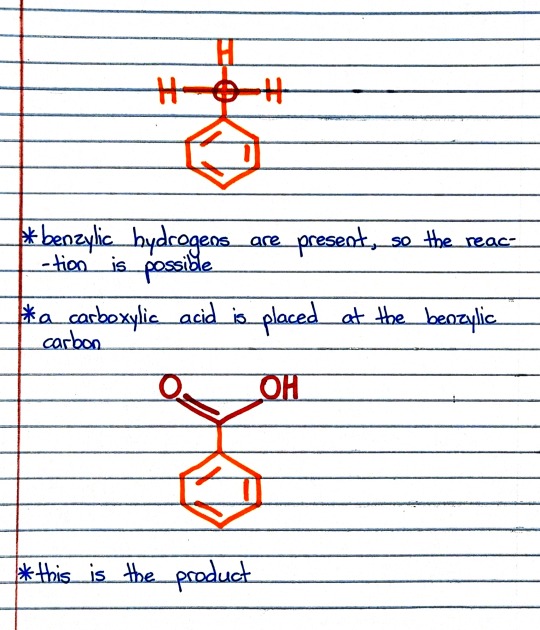
#organic chemistry#ochem#o-chem#o chem#ochem 1#ochem 2#organic chemistry 1#organic chemistry 2#mcat organic chemistry#orgo#reactions#orgo reactions#chemical reactions#orgo mcat#mcat orgo#ochem reactions#studyblr#notes#h2cro4#chromic acid#chromic acid notes#chromic acid reaction
4 notes
·
View notes
Text
خرید اسید کرومیک
http://golhateb.ir
اسید کرومیک (به انگلیسی: Chromic acid) یک ترکیب شیمیایی با شناسه پابکم ۲۴۴۲۵ است. شکل ظاهری این ترکیب، بلورهای قرمز است. فروش اسید کرومیک صنعتی و آزمایشگاهی - قیمت اسید کرومیک در وب سایت فروش مواد شیمیایی ۳۰o۲ - خرید اسید کرومیک با بهترین کیفیت و مناسب ترین قیمت. اسید کرومیک یا کرومیک اسید ( chromic acid ) با فرمول شیمیایی H2CrO4 معمولا بصورت ترکیبی از اسید سولفوریک و دی کرومات شناخته می شود. اسید کرومیک بعنوان یک واسطه در آبکاری کروم می باشد .همچنین در صنایع سرامیک در لعابسرامیکی و شیشه های رنگی استفاده می شود . بعلت محلول بودن اسید کرومیک در اسید سولفوریک (که بنام سولفوکرومیک اسید یا کرومو سولفوریک اسید شناخته می شود ) یک ماده اکسید کننده بسیار قوی شناخته می شود که میتواند بعنوان پاک کننده تجهیزات شیشه ای آزمایشگاهی استفاده شود.
این ماده بعلت ایجاد مشکلات زیست محیطی مورد استفاده قرار نمیگیرد.علاوه بر این ، این اسید مقدار زیادی پارامغناطیس از یون کرومیک بجا می گذارد .
اسید کرومیک قبلا بصورت گسترده ای در براق کردن پوشش برنجی وسایل استفاده می شد .
استفاده chromic acid در صنعت
کرومیک اسید ، جاذب رطوبت و یک اکسید کننده قوی است که به آسانی در آب حل می شود. به طور گسترده ای در صنایعی مانند پوشش فلزات، حفاظت چوب و ساخت نوار مغناطیسی و مواد شیمیایی آلی مورد استفاده قرار گرفته می شود.
این اسید جهت آبکاری در صنعت آبکاری مورد استفاده قرار می گیرد و در واکنش با آند کروم باعث درخشندگی و براق نمودن فلز آبکاری شده می گردد.
تولید کاتالیزورهای الکترولیتی کروم.
در ترکیبات مربوط به مخلوط شن و ماسه هسته و شن و ماسه ریخته گری برای تولید مواد ریخته گری به کار میرود. همچنین در فرآیندهای اچ و دیگر اهداف نیز استفاده می شود.
تولید و تهیه فلز کروم با کیفیت بالا ، مواد سخت و کاتالیزورهایی برای آبکاری کروم ، انجام کروم سازی و فرآیندهای کنش پذیری.
لینک خرید آنلاین اسید کرومیک:
https://golhateb.ir/product/اسید-کرومیک/
1 note
·
View note
Link
Conjugate acids and bases and naming practice Name the following acids and bases: HF = _________________________ H2SO3 = _______________________ NaOH =________________________ HNO3 = ________________________ H2S = __________________________ KOH = _________________________ H2CrO4 = _______________________ H3PO3 = ________________________ Give the conjugate base of the following acid: HCl = ________________________ NH4+ = _______________________ H2SO4 = _____________________ H2O = _______________________ Give the conjugate acid of the following base: Br- = _______________ HCO3- = ______________ H2O = _______________ HSO4- = _______________ Identify the acid, base, conjugate acid, and conjugate base for each reaction: HClO4 + H2O → H3O+ + ClO4- H2SO3 + H2O → H3O+ + HSO3- HC2H3O2 + H2O → H3O+ + C2H3O3- H2S + H2O → H3O+
0 notes
Photo

مشخصات فیزیکی و شیمیایی کرومیک اسید چیستند؟
نام شیمیایی : اسید کرومیک.
اسامی مترادف : کرومیک اسید، chromic acid ،Tetraoxochromic acid.
گرید محصول : صنعتی / آزمایشگاهی.
برندهای موجود : 1. اسید کرومیک ترک sisecam / چین / هند / بایر آفریقا / آلمان.
فرمول شیمیایی : H2CrO4.
خلوص : اسید کرومیک 99 درصد.
شکل ظاهری : شکل ظاهری این ترکیب ، پولک های قرمز است.
https://tehranacid.ir/product/chromic-acid/
0 notes
Text
In today experiment you will try to synthesize 9-fluorenone by an oxidation reaction with reagent Jone's (H2CrO4). a. Draw the overall reaction of oxidation of 9-fluorenol with Jones' reagent to 9-fluorenone
In today experiment you will try to synthesize 9-fluorenone by an oxidation reaction with reagent Jone’s (H2CrO4). a. Draw the overall reaction of oxidation of 9-fluorenol with Jones’ reagent to 9-fluorenone
1. In today experiment you will try to synthesize 9-fluorenone by an oxidation reaction with reagent Jone’s (H2CrO4). a. Draw the overall reaction of oxidation of 9-fluorenol with Jones’ reagent to 9-fluorenone. (1 pts) b. What is the purpose of adding 2-propanol after the reaction is done?

View On WordPress
0 notes
Photo

DE ENGRAÇADO NÃO TEM NADA... O nome ÁCIDO CRÔMICO refere-se a um conjunto de compostos gerados pela acidificação de soluções contendo ânions cromato e dicromato ou pela dissolução de trióxido de cromo em ácido sulfúrico.Frequentemente a tais substâncias são atribuídas as fórmulas H2CrO4 e H2Cr2O7. É muito utilizado em processos de cromagem e em vitrificação de cerâmicas e vidros coloridos. É também utilizado para limpeza de materiais de vidro usados em laboratórios. Uma das principais características do ácido crômico é sua capacidade oxidante. Para se evitar acidentes, deve ser evitado o contato do ácido com matéria orgânica, óleos, massas e outros materiais que também se oxidam rapidamente. O uso do ácido crômico deve ser feito de forma muito responsável, pois traz sérios riscos à saúde humana, podendo, por exemplo, causar câncer a quem manipula, danos genéticos hereditários, fertilidade enfraquecida. Devido à sua alta toxicidade, a inalação de seus vapores pode causar queimaduras no sistema respiratório e até ulcerações nas mucosas do nariz. A exposição repetida e prolongada pode conduzir à perfuração do septo nasal. . #fisicoquimica #fisicayquimica #iloveyouquimica #fisicoquimica #labquimica #quimicaorganica #chemicalengineer #chemicalreactions (em Salto, Sao Paulo) https://www.instagram.com/iloveyouquimica/p/BsbOFRqFrSi/?utm_source=ig_tumblr_share&igshid=y9l71nvntu1r
#fisicoquimica#fisicayquimica#iloveyouquimica#labquimica#quimicaorganica#chemicalengineer#chemicalreactions
0 notes
Text
Cro3 là oxit gì ? Ứng dụng của Cro3 trong cuộc sống
Crom là nguyên tố phổ biến thứ 21 trong vỏ Trái Đất với hàm lượng 122ppm , cùng tìm hiểu về CrO3 là oxit gì, nguyên tố Crom và các oxit của crom nhé.
CrO3 là oxit gì
Crom là một kim loại chuyển tiếp có ký hiệu hoa 1học là Cr, số hiệu nguyên tử là 24. Crom là kim loại rất cứng (chỉ thua kim cương) có màu trắng ánh bạc.
Crom là kim loại nặng có khối lượng 7,2g/ cm3, khó nóng chảy nhưng vẫn rèn được. Trử lượng crom lớn nhất trên thế giới tập trung chủ yếu tại khu vực Nam Phi .
Trong môi trường tự nhiên, Crom nằm chủ yếu trong khoáng vật cromit FeCr2O4(FeO.Cr2O3), oxit crom được tách ra khỏi quặng, sau đó được điều chế bằng phương pháp nhiệt nhôm như sau: Cr2O3 + 2Al 2Cr + Al2O3.
Với phương pháp trên, độ tinh khiết của Crom thu được rất cao(từ 97-99%).
Crom được ứng dụng rộng rãi trong cuộc sống con người :
Mạ crôm xe chính là ứng dụng phổ biến nhất mà mọi người biết.
Crom được dùng để mạ các vật dụng bằng thép hay bằng các kim loại khác, vừa giúp tăng tình thẩm mỹ đồng thời bảo vệ các vật dụng kim loại khỏi bị ăn mòn.
Trong ngành công nghiệp thì crom được dùng trong ngành công nghiệp sản xuất thép là chủ yếu.
Tính chất vật lý của Crom
CrO3 được đọc là crom (III) oxit hay crom trioxit, là những tinh thể hình kim rất độc khi tiếp xúc với con người, khả năng hút ẩm rất cao và có màu đỏ thẫm.
Crom khá độc nếu vô tình tiếp xúc
Nhiệt độ nóng chảy của CrO3 tương đối thấp là 1970 độ C, so với CrO và Cr2O3 thì nhiệt độ này thấp hơn rất nhiều.
Tính chất hóa học của Crom
CrO3 không phải là oxit lưỡng tính nên kém bền, khi kết hợp cùng với nước sẽ tạo ra hỗn hợp axit đicromic H2Cr2O7 và axit cromic H2CrO4:
2CrO3 + H2O H2Cr2O7 : axit đicromic màu da cam
CrO3 + H2O H2CrO4 : axit cromic màu vàng
CrO3 là một chất oxi hóa rất mạnh, vì thế nó dễ dàng gây nổ khi oxi hóa với CO, P, I2,HBr, C, HI , S….: 2CrO3 + 2NH3 Cr2O3 + N2 + 3H2O
Cách điều chế và ứng dụng trong cuộc sống
Khi axit sunfuric đặc kết hợp với đicromat kim loại kiềm hay dung dịch bão hòa cromat , để nguội sẽ tạo ra Crom trioxit : K2Cr2O7 + H2SO4 2CrO3 + K2SO4 + H2O
Các nhà khoa học đã thí nghiệm và ứng dụng đặc tính oxi hóa của CrO3 trong việc làm sạch cách dụng cụ bằng thủy tinh như ly, tách, bình cầu….
Hy vọng qua bài viết trên bạn đã hiểu được cro3 là oxit gì và các tính chất của cro3. Nếu muốn bỉ sung thêm kiến thức hãy cùng thảo luận với chúng tôi qua comment bên dưới nhé.
The post Cro3 là oxit gì ? Ứng dụng của Cro3 trong cuộc sống appeared first on lagithe.info.
0 notes
Text
HỆ THỐNG HÓA KIẾN THỨC MÔN HÓA HỌC 12
HỆ THỐNG HÓA KIẾN THỨC MÔN HÓA HỌC 12
Chương 1: Este –lipit
Chương 2: Cacbohidrat
Chương 3: Amin, aminoaxit
Chương 4: Polime
Chương 5: Đại cương kim loại
Chương 6: Kim loại kiềm kiềm thổ - Nhôm
Chương 7: Sắt – Crom
Chương 8: Nhận biết
Chương 9: Hóa học với môi trường
A. PHẦN HỮU CƠ
Cần hệ thống kiến thức theo từng chủ đề
I. Các khái niệm cần nhớ - Đồng phân, danh pháp
II. Tính chất vật lí : Trạng thái, so sánh nhiệt độ sôi, tính tan và ứng dụng
III. Tính chất hóa học ( giới hạn trong chương trình lớp 12)
1. Những chất phản ứng với Na (K) giải phóng H2 là: Ancol, phenol, axit , H2O
2.Những chất phản ứng dung dịch NaOH (KOH) là: phenol, axit , muối amôni, aminoaxit
3. Những chất phản ứng với dung dịch NaOH (KOH) khi đun nóng: là este; dẫn xuất
4. Những chất phản ứng với CaCO3, NaHCO3 giải phóng CO2 là: axit RCOOH
5. Những chất phản ứng với dung dịch axit HCl, HBr là : ancol, amin, anilin, aminoaxit, muối amoniRCOONH4, muối của amin RNH3Cl
6. Những chất có phản ứng với dung dịch AgNO3/ dd NH3 :
- khi đun nóng có kết tủa Ag : (phản ứng tráng bạc ) : các chất có nhóm –CHO : RCHO , HCOOH , HCOOR , HCOONH4, glucozơ, fructozơ, mantozơ .
7. Những chất có phản ứng với Cu(OH)2/NaOH
- Tạo thành muối, nước: là axit
- Tạo thành dung dịch có màu xanh lam: các chất có nhiều nhóm OH kế cận: như etilen glycol ; glixerol , glucozơ; Fructozơ ; Mantozơ ; Saccarozơ.
- Khi đun nóng tạo thành kết tủa có màu đỏ gạch Cu2O là : các chất có nhóm –CHO
8. Những chất có phản ứng dung dịch nước brôm:
- Làm mất màu dung dịch nước brôm: các chất không no có liên kết pi ( = ; ≡ ); andehit RCHO bị oxi hóa bới ddBr2.
- Tạo kết tủa trắng: phenol; anilin.
9. Những chất có phản ứng cộng H2 ( Ni): các chất có liên kết pi: ( =; ≡ ); benzen; nhóm chức andehit RCHO; Nhóm chức Xeton RCOR; tạp chức: glucozơ, fructozơ .
10. Các chất có phản ứng thủy phân : Tinh bột; xenlulozơ; mantozơ; saccarozơ, peptit; protein, este, chất béo
11. Các chất có phản ứng trùng hợp : những chất có liên kết đôi ( C=C) hay vòng không bền
12. Những chất có phản ứng trùng ngưng là : Các chất có nhiều nhóm chức.
13. Polime thiên nhiên: cao su thiên nhiên, tơ tằm, bông, xenlulozo , tinh bột
14. Polime nhân tạo ( bán tổng hợp ): tơ Visco, tơ axetat, xenlulozo trinitrat.
15. Polime tổng hợp ( điều chế từ phản ứng trùng hợp hay trùng ngưng): các polime còn lại : PE, PVC….
16. Polime được điều chế từ phản ứng trùng ngưng: Nilon-6 , Nilon-7, Nilon-6,6, tơ lapsan, nhựa PPF
17. Polime được điều chế từ phản ứng trùng hợp: ( còn lại ) : PE, PVC , Caosubuna , Caosu buna-S ,tơnitron….
18. Tơ có nguồn gốc xenlulozo : sợi bông, tơ Visco, tơ axetat
19. Tơ poliamit : Nilon-6 , Nilon-7 , Nilon-6,6 20. Tripeptit….polipeptit, protein lòng trắng trứng: có phản ứng màu biure ( phản ứng Cu(OH)2 có màu tím.
IV. So sánh lực bazo của các amin ( amin no > NH3 > Amin thơm)
V. Môi trường của dung dịch, PH ( chú ý phenol , anilin , Glixin không làm quỳ tím đổi màu)
Axit RCOOH: quỳ tím hóa đỏ.
Amin no : quỳ tím hóa xanh. aminoaxit ( tùy vào số nhóm chức )
Muối của axit mạnh bazo yếu quỳ hóa đỏ.
Muối của axit yếu bazo mạnh quỳ hóa xanh.
VI. Nhận biết các chất hữu cơ
- Nếu chỉ dùng 1 hoá chất nhận biết hợp chất hữu cơ thì hóa chất thường sử dụng là:
• Quỳ tím ( nếu thấy có amin, axit… ) * Cu(OH)2 ( Nếu thấy có Glucozo , Glixerol , andehit.. )
• Dung dịch brom ( Nếu thấy có Phenol , anilin, hợp chất không no ..
- Phân biệt giữa Glucozơ và Fructozơ dùng dung dịch brom
- Phân biệt giữa dipeptit và các polipeptit khác dùng Cu(OH)2 ( phản ứng màu biore)- Nhận biết protein (lòng trắng trứng …) : dùng Cu(OH)2 : có màu tím xuất hiện hoặc dùng HNO3 : có màu vàng
VII. Điều chế
- Este ( từ phản ứng este hóa : axit phản ứng với ancol ) chú ý các este đặc biệt : vinylaxetat , phenyl axetat ( điều chế riêng )
- Glucozo( từ tinh bột , xenlulozo, mantozo)
- Ancol etylic ( từ glucozo bằng phương pháp lên men)
- Anlin ( từ nitrobenzen)
- Các polime điều chế từ phản ứng trùng ngưng : ( nilon -6, nilon-7, nilon-6,6 , tơ lapsan nhựa PPF)
- Các polime điều chế từ phản ứng trùng hợp : ( PE , PVC , PVA , cao su buna , tơ nitron ….)
B. PHẦN KIM LOẠI
1. Học thuộc
Cấu hình eNa( z=11) [Ne] 3s1 ; Mg ( z=12) [Ne] 3s2 ; Al( z=13) [Ne] 3s2 , 3p1 ; Fe( z=26) [Ar] 3d6, 4s2 ; Cr( z=24) [Ar] 3d5, 4s1 và suy ra vị trí trong bảng tuần hoàn.
2. Nhớ qui luật biến đổi tính chất trong nhóm A ( từ trên xuống: tính kim loại tăng , bán kính nguyên tử tăng , năng lượng ion hóa giảm , độ âm điện giảm)
Nhớ qui luật biến đổi tính chất trong chu kì ( từ trái sang phải : tính kim loại giảm , bán kính nguyên tử giảm , năng lượng ion hóa tăng, độ âm điện tăng , tính phi kim tăng)
3. Tính chất Vật lí chung của kim loại
Tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim. Các tính chất vật lí chung này là do các electron tự do trong kim loại gây ra.
- Kim loại dẻo nhất là : Au
- Kim loại dẫn điện tốt nhất là: Ag
- Kim loại nhẹ nhất là : Li ( D = 0,5 g/cm3)
- Kim loại nặng nhất: Os ( D= 22,6 g/ cm3 )
- Kim loại cứng nhất : Cr ( độ cứng =9/10)
- Kim loại mềm nhất: Cs ( độ cứng = 0,2 )
- Kim loại có nhiệt độ nóng chảy cao nhất là : W ( 34100c) thấp nhất là : Hg (-390c)
4. Nhớ dãy điện hóa của kim loại và áp dụng: ( kiến thức trọng tâm) đặc biệt chú ý cặp Fe3+/Fe2+
- Kim loại trước cặp Fe3+/Fe2+ phản ứng với Fe3+ ví dụ : Cu + 2FeCl3 -> CuCl2 + 2FeCl2. Ví dụ Fe + 2FeCl3 -> 3FeCl2
5. Tính chất hóa học chung của kim loại : Tính khử: ( dễ bị oxi hóa)
- Kim loại phản ứng với oxi : ( trừ Ag , Pt , Au )
- Kim loại phản ứng với HCl và H2SO4 loãng : ( trừ Pb , Cu , Ag , Hg, Pt , Au )
- Kim loại phản ứng với HNO3 và H2SO4 đặc : ( trừ Pt , Au )
- Kim loại phản ứng với HNO3 đặc nguội và H2SO4 đặc nguội : ( trừ Al, Fe , Cr, Pt , Au )
- Kim loại phản ứng với nước ở đk thường : ( có : nhóm IA , Ca, Sr , Ba )
- Kim loại phản ứng dung dịch kiềm ( NaOH , KOH , Ba(OH)2 ) nhớ nhất : Al , Zn
- Kim loại trước cặp Fe3+/Fe2+ phản ứng với Fe3+ ví dụ : Cu + 2FeCl3 CuCl2 + 2FeCl2
6. Điều chế kim loại
Nguyên tắc : khử ion kim loại trong các hợp chất thành kim loại tự do: Mn+ + ne M
Phương pháp : điện phân nóng chảy : dùng điều chế kim loại nhóm IA , IIA , Al điện phân dung dịch muối : dùng điều chế kim loại sau nhôm
Nhiệt luyện : dùng điều chế các kim loại : ( Zn , Cr , Fe ………)
Thủy luyện : thường nhất dùng điều chế các kim loại : ( Cu , Ag ………)
7. Sự ăn mòn kim loại
Cần phân biệt giữa 2 loại ăn mòn
- Ăn mòn hóa học ( không làm phát sinh dòng điện )
- Ăn mòn điện hóa ( chú ý gợi ý của đề : có 2 kim loại, hợp kim gang, thép để trong dung dịch chất điện li HCl, dd muối, không khí ẩm …)
Chú ý kim loại có tính khử mạnh hơn thì đóng vai trò cực âm ( anod) bị ăn mòn. Ở cực âm xãy ra quá trình oxi hóa. Dòng electron di chuyển từ cực âm sang cực dương tạo nên dòng điện )
Ví dụ hợp kim Zn- Cu để trong dung dịch HCl loãng bị ăn mòn điện hóa ( Zn làm cực âm và bị ăn mòn )
8. Học thuôc hai loại hợp kim của sắt : Gang và thép
a. Gang : là hợp kim của sắt và C (% C : 2-5%) và một số các nguyên tố : Si , S, Mn , P
- Nguyên tắc sản suất : Dùng than cốc (CO) khử sắt oxit ở nhiệt độ cao.
- Nguyên liệu : quặng sắt , than cốc , chất chảy (CaCO3 hay SiO2)
b. Thép: là hợp kim của sắt và C (% C : 0,01-2%) và một lượng rất nhỏ các nguyên tố : Si , S, Mn , P
- Nguyên tắc sản suất : Oxi hóa C , Si , S, P có trong gang để làm giảm hàm lượng của các nguyên tố này .
- Nguyên liệu : gang trắng , không khí , chất chảy (CaCO3 hay SiO2)
9. Công thức một số chất cần nhớ và ứng dụng
- Chứa Ca, Mg: CaCO3.MgCO3: đolomit ; CaSO4.2H2O thạch cao sống; CaSO4.H2O thạch cao nung CaSO4.thạch cao khan; CaCO3: đá vôi
- Chứa Al : Al203.2H2O boxit ; Na3AlF6 : criolit ; K2SO4.Al2(SO4)3.24H2O : phèn chua
- Chứa Fe : Fe2O3 ; hematit ; Fe3O4 ;manhetit ; FeCO3xiderit ; FeS2 pirit
10. Nước cứng nước mềm và các phương pháp làm mềm nước cứng
- Nước cứng là nước chứa nhiềuu ion Ca2+ hay Mg2+
- Nước mềm là nước chứa rất ít hay không chứa ion Ca2+ , Mg2+
- Nguyên tắc làm mềm nước : Làm giảm nồng độ các ion Ca2+ , Mg2+ trong nước cứng bằng cách chuyển các ion này thành các chất không tan .
- Để làm mềm nước cứng tạm thời có thể dùng : đun sôi, ddNaOH, Ca(OH)2 vừa đủ, Na2CO3, Na3PO4- Để làm mềm nước cứng vỉnh cữu hay toàn phần dùng : Na2CO3, hay Na3PO4
11.Thuộc tên Kim loại kiềm
Nhóm IA : Li, Na, , Rb, Cs, Fr: ( là kim loại nhẹ , mềm , dễ nóng chảy , phản ứng được với H2O tạo dung dịch kiềm , oxit , hidroxit tan trong nước tạo dung dịch kiềm là baz mạnh)
12.Thuộc tên Kim loại kiềm thổ :
Nhóm IIA : Be, Mg, Ca, Sr, Ba, Ra: ( chú ý Ca , Ba , Sr phản ứng với nước tạo dung dịch kiềm. CaO, BaO, SrO, Ca(OH)2, Ba(OH)2, Sr(OH)2 tan trong nước tạo dung dịch kiềm
13. Phản ứng đặt trưng nhất bài Al là phản ứng với dung dịch kiềm Al + NaOH + H2O -> NaAlO2 = 3/2 H2 Al2O3 , Al(OH)3 tan trong dung dịch kiềm và dung dịch axit mạnh
Cần nhớ phản ứng nhiệt nhôm : ví dụ : 2Al + Fe2O3 Al2O3 + 2Fe ( ứng dụng để hàn kim loại )2Al + Cr2O3 Al2O3 + 2Cr ( ứng dụng để sản xuất crom ) Chú ý hiện tượng khi cho từ từ dung dịch NaOH vào dung dịch muối AlCl3 ( có kết tủa trắng , dư NaOH kết tủa tan dần )
14. Sắt
Chú ý:
- Các trường hợp Sắt phản ứng tạo hợp chất sắt (II): sắt phản ứng với HCl, H2SO4 loãng, S, dung dịch muối
- Các trường hợp Sắt phản ứng tạo hợp chất sắt (III): sắt phản ứng với HNO3 dư, H2SO4 đặc nóng dư, Cl2, Br2, dung dịch AgNO3 dư
- Tính chất hóa học của hợp chất Sắt (III) Fe2O3 , FeCl3 ….: là tính oxi hóa
- Hợp chất Sắt (II) FeO, FeCl2: có thể là chất khử hay oxi hóa ( tùy phản ứng )- Các oxit sắt , hidroxit sắt là bazơ.
15. Andre Andre Crom
Chú ý
- Các trường hợp Crom phản ứng tạo hợp chất crom (II) : crom phản ứng với HCl, H2SO4 loãng
- Các trường hợp crom phản ứng tạo hợp chất crom (III) : crom phản ứng với HNO3 dư, H2SO4 đặc nóng dư, Cl2, Br2, O2, S
- Tính chất hóa học của hợp chất crom (IV) CrO3, K2Cr2O7 ….: là tính oxi hóa
- Hợp chất Crom (III) Cr2O3, CrCl3: có thể là chất khử hay oxi hóa ( tùy phản ứng )
- Các oxit CrO, hidroxit Cr(OH)2l à bazơ.
- Các oxit Cr2O3, hidroxit Cr(OH)3 lưỡng tính
- CrO3, H2CrO4, H2Cr2O7: là axit
16. Các chất lưỡng tính cần nhớ
Aminoaxit , RCOONH4 , muối HCO3_ , Al2O3, ZnO, BeO, Cr2O3, Al(OH)3, Zn(OH)2, Be(OH)2, Cr(OH)3.
17. Biết phân biệt các chất vô cơ và các hiện tượng xảy ra trong thí nghiệm.
18. Đọc sơ bài hóa học và môi trường liên hệ các kiến thức trong đời sống.
19. Ghi nhớ điều kiện phản ứng trao đổi ion trong dung dịch (sản phẩm có : kết tủa, hay chất khí, hay chất điện li yếu ).
Xem thêm
giáo trình hán ngữ
giáo trình tiếng hàn
giáo trình tiếng hàn sơ cấp
0 notes
Text
Chromic acid
Chromic acid Names IUPAC name Chromic acid Systematic IUPAC name Dihydroxidodioxidochromium Other names Chromic(VI) acid Tetraoxochromic acid Identifiers CAS Number 7738-94-5 Y ChEBI CHEBI:33143 Y ChemSpider 22834 Y EC Number 231-801-5 Gmelin Reference 25982 Jmol 3D model Interactive image Interactive image PubChem 24425 InChI SMILES Properties Chemical formula CrH2O4 Molar mass 118.01 g·mol−1 Appearance Dark red crystals Density 1.201 g cm−3 Melting point 197 °C (387 °F; 470 K) Boiling point 250 °C (482 °F; 523 K) (decomposes) Solubility in water 169 g/100 mL Acidity (pKa) -0.8 to 1.6 Hazards Lethal dose or concentration (LD, LC): LD50 (median dose) 51.9 mg/kg (H2CrO4·2Na, rat, oral) US health exposure limits (NIOSH): PEL (Permissible) TWA 0.005 mg/m3 REL (Recommended) TWA 0.001 mg Cr(VI)/m3 IDLH (Immediate danger) 15 mg Cr(VI)/m3 Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Y verify (what is YN ?) Infobox references The term chromic acid is usually used for a mixture made by adding concentrated sulfuric acid to a dichromate, which may contain a variety of compounds, including solid chromium trioxide. This kind of chromic acid may be used as a cleaning mixture for glass. Chromic acid may also refer to the molecular species, H2CrO4 of which the trioxide is the anhydride. Chromic acid features chromium in an oxidation state of +6 (or VI). It is a strong and corrosive oxidising agent.
More details Android, Windows
0 notes
Text
Products of H2CrO4 (Ex. 2)


Patreon
#studyblr#notes#my notes#organic chemistry#ochem#orgo#orgo notes#organic chemistry notes#organic chem#orgo chem#study guides#mcat#mcat chemistry#mcat orgo#mcat ochem#mcat organic chemistry#mcat studyblr#premed studyblr#organic chemicals#organic reactions#chemical reactions#advanced chemistry#life science#h2cro4#benzene chemistry
1 note
·
View note
Text
Products of H2CrO4 - Ex. 3


Patreon
#studyblr#notes#my notes#organic chemistry#ochem#orgo#orgo notes#organic chemistry notes#organic chem#orgo chem#study guides#mcat#mcat chemistry#mcat orgo#mcat ochem#mcat organic chemistry#mcat studyblr#premed studyblr#organic chemicals#organic reactions#chemical reactions#advanced chemistry#life science#note cards#flashcards#flash cards
1 note
·
View note