#Miss Suomi 2022
Text
Petra Hämäläinen biography: 10 things about Miss Suomi 2022
Petra Hämäläinen biography: 10 things about Miss Suomi 2022
Petra Hämäläinen is a Finnish beauty queen. Here are 10 more things about her:
youtube
View On WordPress
0 notes
Text
Miss Suomi 2022 results: Savonlinna's Petra Hämäläinen crowned in Kerava, Uusimaa, Finland
Miss Suomi 2022 results: Savonlinna’s Petra Hämäläinen crowned in Kerava, Uusimaa, Finland
beauty pageant: Miss Suomi
national director: Sunneva Sjögrén
edition: 91st
international memberships: Miss Universe, Miss World, Miss International
date: September 17, 2022
venue: AlfaTV, Kerava, Uusimaa, Finland
broadcaster: AlfaTV
hosts: Niko Nousiainen, Sauli Koskinen
performers: Saara Aalto, Janely, Nyxila Dancers
candidates: 20
View this post on Instagram A post shared by Miss…

View On WordPress
0 notes
Text

2022/08/12
Preguntamos a esta señora porqué estaba enfadada y nos dijo que porque había perdido el autobús e iba a llegar muy tarde a casa.
We asked this lady why she was angry and she told us that she had missed the bus and was going to be home very late.
Google translation into Italian:
Abbiamo chiesto a questa signora perché era arrabbiata e ci ha detto che aveva perso l'autobus e che sarebbe tornata a casa molto tardi.
Google Translation into Portuguese:
Perguntamos a essa senhora por que ela estava com raiva e ela nos disse que havia perdido o ônibus e chegaria em casa muito tarde.
Google Translation into French:
Nous avons demandé à cette dame pourquoi elle était en colère et elle nous a dit qu'elle avait raté le bus et qu'elle allait rentrer très tard.
Google Translation into Arabic:
سألنا هذه السيدة عن سبب غضبها وأخبرتنا أنها فاتتها الحافلة وستعود إلى المنزل في وقت متأخر جدًا.
Google Translation into German:
Wir fragten diese Dame, warum sie wütend sei und sie sagte uns, dass sie den Bus verpasst hatte und sehr spät nach Hause kommen würde.
Google Translation into Albanisch:
E pyetëm këtë zonjë pse ishte e inatosur dhe ajo na tha se e kishte humbur autobusin dhe do të kthehet në shtëpi shumë vonë.
Google Translation into Bulgarian:
Попитахме тази жена защо е ядосана и тя ни каза, че е изпуснала автобуса и ще се прибере много късно.
Google Translation into Czech:
Zeptali jsme se této paní, proč se zlobí, a řekla nám, že zmeškala autobus a vrátí se domů velmi pozdě.
Google Translation into Slovak:
Spýtali sme sa tejto pani, prečo sa hnevá, a povedala nám, že zmeškala autobus a príde domov veľmi neskoro.
Google Translation into Slovenian:
To gospo smo vprašali, zakaj je jezna, in povedala nam je, da je zamudila avtobus in bo prišla domov zelo pozno.
Google Translation into Suomi:
Kysyimme tältä naiselta, miksi hän oli vihainen, ja hän kertoi meille, että hän oli myöhässä bussista ja tulee kotiin hyvin myöhään.
Google Translation into Greek:
Ρωτήσαμε αυτή την κυρία γιατί ήταν θυμωμένη και μας είπε ότι έχασε το λεωφορείο και θα γυρίσει σπίτι πολύ αργά.
Google Translation into Dutch:
We vroegen deze dame waarom ze boos was en ze vertelde ons dat ze de bus had gemist en heel laat thuis zou komen.
Google Translation into Norwegian:
Vi spurte denne damen hvorfor hun var sint, og hun fortalte oss at hun savnet bussen og kommer hjem veldig sent.
Google Translation into Polish:
Zapytaliśmy tę panią, dlaczego jest zła, a ona powiedziała nam, że spóźniła się na autobus i wróci do domu bardzo późno.
Google Translation into Romanian:
Am întrebat-o pe această doamnă de ce este supărată și ne-a spus că a pierdut autobuzul și că va veni foarte târziu acasă.
Google Translation into Russian:
Мы спросили эту даму, почему она сердится, и она сказала нам, что опоздала на автобус и вернется домой очень поздно.
Google Translation into Swedish:
Vi frågade den här damen varför hon var arg och hon berättade att hon missade bussen och kommer hem väldigt sent.
Google Translation into Turkish:
Bu bayana neden sinirli olduğunu sorduk ve otobüsü kaçırdığını ve eve çok geç geleceğini söyledi.
Google Translation into Bengali:
আমরা এই ভদ্রমহিলাকে জিজ্ঞাসা করেছিলাম যে সে কেন রেগে ছিল এবং সে আমাদের বলেছিল যে সে বাসটি মিস করেছে এবং খুব দেরিতে বাড়ি ফিরবে।
Google Translation into Chinese:
我们问这位女士为什么生气,她告诉我们她错过了公共汽车,并且会很晚才回家。
Google Translation into Korean:
우리는 이 여성에게 왜 화가 났는지 물었고 그녀는 버스를 놓쳤고 매우 늦게 집에 돌아올 것이라고 말했습니다.
Google Translation into Hebrew:
שאלנו את הגברת הזו למה היא כועסת והיא אמרה לנו שהיא פספסה את האוטובוס ותחזור הביתה מאוחר מאוד.
Google Translation into Hindi:
हमने इस महिला से पूछा कि वह गुस्से में क्यों थी और उसने हमें बताया कि वह बस से छूट गई और बहुत देर से घर आएगी।
Google Translation into Indonesian:
Kami bertanya kepada wanita ini mengapa dia marah dan dia memberi tahu kami bahwa dia ketinggalan bus dan akan pulang sangat larut.
Google Translation into Japanese:
私たちはこの女性になぜ怒っているのか尋ねたところ、バスに乗り遅れて非常に遅く帰宅するとのことでした。
Google Translation into Malay:
Kami bertanya kepada wanita ini mengapa dia marah dan dia memberitahu kami bahawa dia terlepas bas dan akan pulang lewat.
Google Translation into Pashtun:
موږ له دې مېرمنې وپوښتل چې ولې په غوسه ده، هغې موږ ته وویل چې هغه بس له لاسه ورکړی او ډیر ناوخته کور ته راځي.
Google Translation into Persian:
از این خانم علت عصبانیتش را پرسیدیم و او به ما گفت که اتوبوس را از دست داده و خیلی دیر به خانه می آید.
Google Translation into Tagalog:
Tinanong namin ang babaeng ito kung bakit siya nagalit at sinabi niya sa amin na na-miss niya ang bus at uuwi ng gabi.
Google Translation into Thai:
เราถามผู้หญิงคนนี้ว่าทำไมเธอถึงโกรธ เธอบอกเราว่าเธอตกรถและจะกลับบ้านดึกมาก
Google Translation into Urdu:
ہم نے اس خاتون سے پوچھا کہ وہ غصے میں کیوں ہے اور اس نے بتایا کہ اس کی بس چھوٹ گئی ہے اور بہت دیر سے گھر آئے گی۔
Google Translation into Ukrainian:
Ми запитали цю жінку, чому вона сердиться, і вона сказала нам, що спізнилася на автобус і повернеться додому дуже пізно.
#Tromso#VisitTromso#Noruega#Norway#Sculpture#Angry#Lady#BusStop#Missed#Bus#Wait#Traveler#Beauty#CoupleGoals#GoodVibes#Plushies#Maharashtra#ペンギン
2 notes
·
View notes
Photo
Neljän COVID-rokotteen Euroopassa julkisesti saatavilla olevan datan tarkastelua (30.3.2021)


Kirjoittanut: Catherine FRADE
Julkaistu: 1. huhtikuuta 2021

Lääketieteen tohtorina, entisenä lääketeollisuuden kansainvälisen sääntelyn johtajana haluan valaista ymmärrystänne virallisista tiedoista koskien neljää COVID-19 -rokotetta. Kaikki alla esitetyt tiedot on ladattavissa tästä linkistä. Olin innostunut työstäni laillisten tekstien kenttätutkimuksessa, jotta osaisin kehittää parhaiten lääkkeitä ja työskennellä synergiassa yrityksen ja terveysviranomaisten eri osastojen kanssa Ranskassa ja ulkomailla (jopa 83 maahan). 30. maaliskuuta 2021 Pfizer-, Moderna-, Astra Zeneca- ja Janssen-laboratoriot ovat saaneet ehdollisen myyntiluvan 4: lle COVID-19-rokotteelle (joulukuun 2020 ja maaliskuun 2021 välillä). Nykytilanteen ymmärtämiseksi on välttämätöntä käyttää lähdetietoja, kentällä toimimattoman henkilön on vaikea tunnistaa. Tämän artikkelin tarkoituksena on siis valaista julkista tietoa näistä neljästä COVID-19-rokotteesta viittaamalla kuhunkin lähteeseen, jotta niiden aitous voidaan vahvistaa. Tästä syystä löydät tästä artikkelista linkit myyntilupien virallisiin asiakirjoihin ja yhteenvedot Euroopan lääkeviraston (EMA) arvioimista tieteellisistä tutkimuksista .
Ensinnäkin haluan selventää, että minulla ei ole eturistiriitoja lääketeollisuuden kanssa.
1. Ensinnäkin on tärkeää tietää, mikä ehdollinen myyntilupa on:
Myyntilupa (Marketing Authorization, MA/ML) myönnetään, kun tuote on osoittanut laadun, tehokkuuden ja turvallisuuden positiivisella hyöty-riskisuhteella (eli että sillä on enemmän hyötyjä kuin riskejä). Myyntiluvan saaminen on edellytys lääkkeen, mukaan lukien rokotteet, myymiselle. Kaikki MA-hakemuksen aikana tehdyt tutkimukset on tiivistetty EPAR-lausekkeeseen (= European Public Assessment Report). Se julkaistaan Euroopan lääkeviraston (EMA) verkkosivustolla. Mukana ovat myös suunnitellut tutkimukset, joita ei ole vielä tehty. Tämä aikataulu, joka kestää vuodet 2021-2025 COVID-19-rokotteesta riippuen, on määritelty ehdollisen myyntiluvan liitteissä ja EPAR-lausunnossa. Myyntilupa myönnetään myyntiluvan haltijalle (Marketing Authorization Holder, MAH). Ehdolliset myyntiluvat saatiin laadun, kliinisen ja ei-kliinisen tiedon perusteella rokotetestistä ja/tai bibliografisesta kirjallisuudesta. Bibliografisen kirjallisuuden tiedot ovat tunnustetuissa tieteellisissä lehdissä julkaistuja tutkimuksia, jotka on kirjoittanut myyntilupaa pyytäneen laboratorioon liittymättömät ja ulkopuoliset ryhmät. Nopeutetulla keskitetyllä menettelyllä saatu eurooppalainen myyntilupa sallii samanaikaisen markkinoinnin seuraavissa 30 maassa (Euroopan unioni ja Euroopan vapaakauppaliitto): Saksa, Itävalta, Belgia, Bulgaria, Kypros, Kroatia, Tanska, Espanja, Viro, Suomi, Ranska, Kreikka, Unkari, Irlanti, Islanti, Italia, Latvia, Liechtenstein, Liettua, Luxemburg, Malta, Norja, Alankomaat, Puola, Portugali, Romania, Slovakia, Slovenia, Ruotsi, Tšekki. Esimerkiksi Pfizerin EPAR (sivut 67 ja 114) päivämäärällä 19. helmikuuta 2021, joka on tähän mennessä eniten käytetty COVID-19-rokote, jolla on laajin käyttöindikaatio (yli 16-vuotiaat), mainitsee että tärkein ns. kliininen tutkimus on vaiheen 1/2/3 tutkimus, joka on edelleen kesken.
Alkuperäinen englanninkielinen EPAR Käännös Study C4951001: A Phase 1/2/3, Placebo-Controlled, Randomized, Observer-Blind, Dose-Finding Study to Evaluate the Safety, Tolerability, Immunogenicity, and Efficacy of SARS-COV-2 RNA Vaccine Candidates Against COVID-19 in Healthy Individuals The safety evaluation is based on one ongoing Phase 2/3 study that at the time of data cut-off (14-Nov-20) included 43,448 subjects who received either two doses of BNT162b2 30μg (n = 21,720) or placebo (n = 21,728). Overall, the reported reactogenicity profile are in line with any authorized vaccine. In addition, the frequency of reported AEs and SAEs were low. The emerging safety profile is presently considered favorable. Long term safety data, interaction with other vaccines, data on use in pregnancy and other subgroups (eg frail subjects, or subjects with pre-existing autoimmune diseases) are missing at this stage. The lack of long-term follow up renders the data provided non-comprehensive. Therefore, the delivery of the final C4951001 study report, including a 2-year follow up of the studied population, is classified as a specific obligation in the context of a conditional marketing authorization. The plan for the generation of further safety data post authorization is described in the section below. Tutkimus C4951001: Vaihe 1/2/3, lumekontrolloitu, satunnaistettu, tarkkailija-sokea, annosmääritystutkimus rokottajaehdokkaiden turvallisuuden, siedettävyyden, immunogeenisuuden ja tehokkuuden arvioimiseksi SARS-COV-2-RNA-rokotteelle COVID-19:a vastaan terveillä yksilöillä. (sivu 67) Turvallisuusarviointi perustuu käynnissä olevaan vaiheen 2/3 tutkimukseen, johon tietojen sulkemishetkellä (14.-20.11.) osallistui 43 448 potilasta, jotka saivat joko kaksi 30 μg: n annosta (n = 21 720) tai lumelääkettä (n = 21 728). Ilmoitettu reaktogeenisuusprofiili on kaiken kaikkiaan yhdenmukainen minkä tahansa lisensoidun rokotteen kanssa. Lisäksi ilmoitettujen haittavaikutusten ja vakavien haittavaikutusten esiintymistiheys oli pieni. Uusia turvallisuusprofiileja pidetään tällä hetkellä suotuisina. Pitkäaikaiset turvallisuustiedot, vuorovaikutus muiden rokotteiden kanssa, tiedot käytöstä raskauden aikana ja muut alaryhmät (esimerkiksi heikot tai koehenkilöt, joilla on jo autoimmuunisairauksia) puuttuvat tässä vaiheessa. Pitkän aikavälin seurannan puuttuminen tekee toimitetuista tiedoista tyhjentäviä. Siksi tutkimuksen C4951001 loppuraportin toimittaminen, mukaan lukien tutkimusväestön kahden vuoden seuranta, luokitellaan erityiseksi velvoitteeksi ehdollisen myyntiluvan yhteydessä. Suunnitelma ylimääräisten suojaustietojen tuottamiseksi valtuutuksen jälkeen on kuvattu alla olevassa osassa.
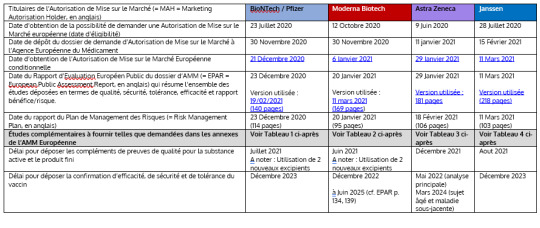
2. Yhteenvetotaulukko EMA:n verkkosivustolla julkaistusta neljän COVID-19-rokotteen myyntiluvasta:
Rekisteröintimenettelyn etenemisestä ja vielä toimitettavista tutkimuksista on oltava näkyvyys. Alla olevassa taulukossa on esitetty viralliset julkiset tiedot EMA-sivustolta: Nämä tiedot on otettu virallisista teksteistä 22. maaliskuuta 2021 (Alleviivatut tekstit viittaavat vastaaviin linkkeihin EMA:n virallisilla verkkosivuilla ja kaikki linkit on tiivistetty tämän asiakirjan loppuun).
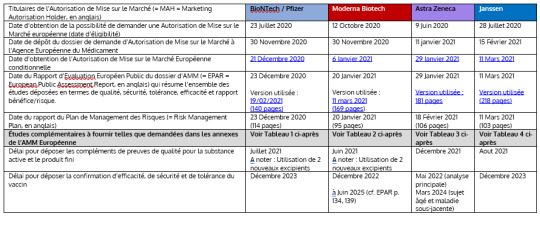
Myyntiluvan haltijat (= MAH) BioNTech / Pfizer Moderna Biotech Astra Zeneca Janssen Päivämäärä, jolloin saatiin mahdollisuus hakea eurooppalaista myyntilupaa (kelpoisuuspäivä) 23. heinäkuuta 2020 12. lokakuuta 2020 9. kesäkuuta 2020 28. heinäkuuta 2020 Myyntilupahakemuksen jättöpäivä Euroopan lääkevirastolle 30. marraskuuta 2020 30. marraskuuta 2020 11. tammikuuta 2021 15. helmikuuta 2021 Ehdollisen eurooppalaisen myyntiluvan saamispäivä 21. joulukuuta 2020 6. tammikuuta 2021 29. tammikuuta 2021 11. maaliskuuta 2021 Päiväys, jona myyntiluvan haltijoiden asiakirja-aineistoa koskeva eurooppalainen julkinen arviointiraportti (= EPAR = englanniksi European Public Assessment Report) sisältää yhteenvedon kaikista toimitetuista tutkimuksista laadun, turvallisuuden, suvaitsevaisuuden, tehon ja hyöty-riskisuhteen suhteen. 23. joulukuuta 2020 Käytetty versio: 19.02.2021 (140 sivua) 20. tammikuuta 2021 Käytetty versio: 11. maaliskuuta 2021 (169 sivua ) 29. tammikuuta 2021 Käytetty versio: 181 sivua 11. maaliskuuta 2021 Käytetty versio (218 sivua) Riskienhallintasuunnitelman raportin päivämäärä 23. joulukuuta 2020 (114 sivua) 20. tammikuuta 2021 (95 sivua) 18. helmikuuta 2021 (106 sivua) 11. maaliskuuta 2021 (103 sivua) Lisätutkimukset toimitetaan Euroopan myyntiluvan liitteiden vaatimusten mukaisesti Katso alla oleva taulukko 1 Katso alla oleva taulukko 2 Katso alla oleva taulukko 3 Katso alla oleva taulukko 4 Määräaika tehoaineen ja lopputuotteen laatua koskevan lisätodistuksen toimittamiseksi Heinäkuu 2021 Huomaa: 2 uuden apuaineen käyttö Kesäkuu 2021 Huomaa: 2 uuden apuaineen käyttö Joulukuu 2021 Elokuu 2021 Määräaika rokotteen tehokkuuden, turvallisuuden ja sietokyvyn vahvistamisen toimittamiselle Joulukuu 2023 Joulukuu 2022 kesäkuuhun 2025 (vrt. EPAR s. 134, 139) Toukokuu 2022 (pääanalyysi) Maaliskuu 2024 (vanhukset ja perussairaus) Joulukuu 2023
3. Näiden julkisten tietojen analyysistä käy ilmi, että:
Nämä rokotteet ovat saaneet ehdollisen myyntiluvan, joka on voimassa yhden vuoden tavallisten myyntilupien viiden vuoden sijaan. Käynnissä olevat ja suunnitellut tutkimukset on saatava päätökseen, jotta voidaan hankkia vakiomuotoinen MA.
Vaikka kliiniset tutkimukset on suunniteltu alkavaksi, ne eivät ole täydellisiä, ja jotkut eivät ole vielä alkaneet. Rokotteesta riippuen lopulliset määräajat suunnitellaan vuosien 2022 ja 2025 välille (katso yllä oleva taulukko).
Yhden laboratorion COVID-19- rokotteen vaihdettavuudesta muiden laboratorioiden muiden COVID-19-rokotteiden kanssa rokotusaikataulun täyttämiseksi ei ole tietoa.
Käyttö rokote on tarkoitettu 18-vuotiaille , paitsi että Pfizerin ilmoitettu ikä on 16-vuotiaasta.
”Rokotteiden turvallisuutta ja tehoa lapsilla ja alle 18-vuotiailla nuorilla ei ole vielä varmistettu.” Tämä koskee Modernaa, Astra-Zenecaa ja Janssenia, joista ” tietoja ei ole saatavilla”. Sama Pfizerin tapauksessa ”lapsilla ja alle 16-vuotiailla nuorilla, joiden tietoja on rajoitetusti”.
Tietoa raskaana olevista naisista on hyvin rajallisesti (hylkäämiskriteerejä kliinisistä tutkimuksista): vähän tai ei lainkaan tietoa turvallisuudesta ja tehosta on toistaiseksi tiedossa. ( Taulukko 5 esimerkkinä). Raskaana olevien naisten rokottamista voidaan harkita vain tapauskohtaisesti. Pfizer-, Moderna- ja Janssen-rokotteiden osalta myyntiluvan liitteessä I esitetyssä tieteellisessä esitteessä (valmisteyhteenveto) ilmoitetaan, että Rokotteen käytöstä raskaana oleville naisille on vain vähän tietoja. Eläinkokeet eivät ole tuottaneet suoria tai epäsuoria haitallisia vaikutuksia raskauteen, alkion/sikiön kehitykseen, synnytykseen tai postnataaliseen kehitykseen (ks. AMM: n liitteessä I oleva 5.3 kohta). Käyttöä raskaana oleville naisille tulee harkita vain, jos mahdolliset hyödyt ovat suuremmat kuin mahdolliset riskit äidille ja sikiölle . ” Astra Zenecan pakkausselosteessa ei mainita vastaavia tietoja: ”Jos olet raskaana tai imetät, epäilet olevasi raskaana tai suunnittelet lapsen hankkimista, kysy neuvoa lääkäriltäsi, apteekista tai sairaanhoitajalta rokotteen ottamiseksi.”
Kokemuksen perusteella mikä tahansa markkinoille saatettu lääke antaa mahdollisuuden tuoda esiin laajamittaisia haittavaikutuksia, joita ei ole esiintynyt tai on harvoin esiintynyt kliinisissä tutkimuksissa. Tämä tarkoittaa konkreettisesti, että rokotuksiin liittyvät haittavaikutukset voivat ilmetä ajan myötä (mikä todennäköisesti selittää Astra-Zeneca-jakson maaliskuun puolivälissä 2021).
Nopeutetun keskitetyn eurooppalaisen menettelyn mukainen rokotteiden ehdollinen myyntilupa ”annettiin kansanterveyden eduksi täyttämään lääketieteellinen tarve”.
Jotkut professorit ja lääkärit ilmoittivat havainneensa alalla lääkeyhdistelmistä muodostettujen hoitojen tehokkuuden: viruslääkkeet, antibiootit, vitamiinit, ravintolisät jne. Tiedämme sen jälkeen tieteellisten julkaisujen erilaisesta kohtelusta käydyn keskustelun, joka voisi olla oikeudellisesti hyväksyttävää uusien rokotteiden ehdollisen myyntilupahakemuksen yhteydessä ja jota ei voida hyväksyä monien vuosien ajan käytettyjen lääkkeiden käytöstä (vrt. hydroksiklorokiini) …Jopa nykypäivänä asiasta edelleen debatoidaan.
Johtopäätös
Yhteenvetona voidaan todeta, että 30 maassa epätäydellisten ja/tai bibliografisten tutkimusten ja tulevien tutkimusten perusteella saatu ehdollinen eurooppalainen myyntilupa antaa ymmärtää, miten COVID-19-rokotteen antaminen vuonna 2021 on laajamittaisesti tutkittu. Ihmiset, jotka on rokotettu osana vielä kesken olevia tai tulevia tutkimuksia (kuten lapset, raskaana olevat naiset ja kaikki EPAR-taulukoissa esitetyt taulukot), joutuvat siksi kokeellisten tutkimus- ja kehitysprotokollien alaisiksi. Jokaisella on ennen rokotusta oikeus pyytää kaikki tietoisen suostumuksensa kannalta hyödylliset tiedot, mukaan lukien lääkityksen ohjeet (katso myyntiluvan liitteet, linkit tämän asiakirjan lopussa olevaan liitteeseen 6. Asiakirjat). Lisäksi ennalta varautumisen periaatteen on oltava vallitseva jo ennen mainitun suostumuksen saamista.

Tänään olen suuntautunut ammatillisessa toiminnassani ihmisten ja organisaatioiden terveyden ja elämänlaadun tukemiseen ja kouluttamiseen heidän tarkoituksensa mukaisesti, ja olen hyvin kiintynyt kaikkien kunnioittamiseen. Farmasian tohtorina ja kokonaisvaltaisena työpsykologina (CV liitteenä) yhdistän rationaaliset tieteet tietoisuuden tulokulmiin kaikissa muodoissaan. Näiden dokumentti- ja sääntelylähteiden tuella halusin antaa sinun löytää itsellesi hyvän ymmärryksen teksteistä ja siten valaista näitä uusia rokotteita. Dr. Catherine FRADE, ansioluettelo löytyy tästä. Farmasian tohtori, psykologi ja työpsykopatologi
Taulukko 1: Pfizer-myyntiluvan liite IIE, sivut 18 ja 19
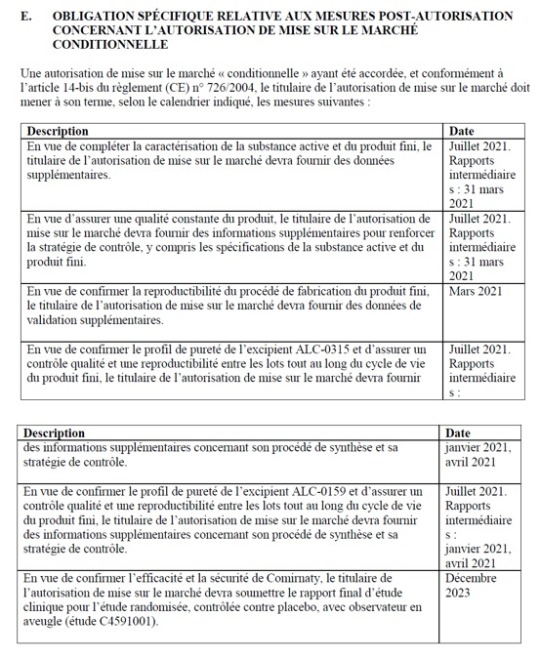
Taulukko 2: Modernan myyntiluvan liite IIE, sivu 15
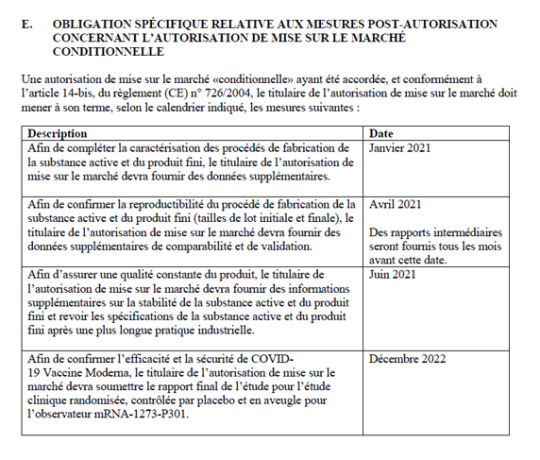
Taulukko 3: Astra Zenecan myyntiluvan liite IIE, sivut 14 ja 15
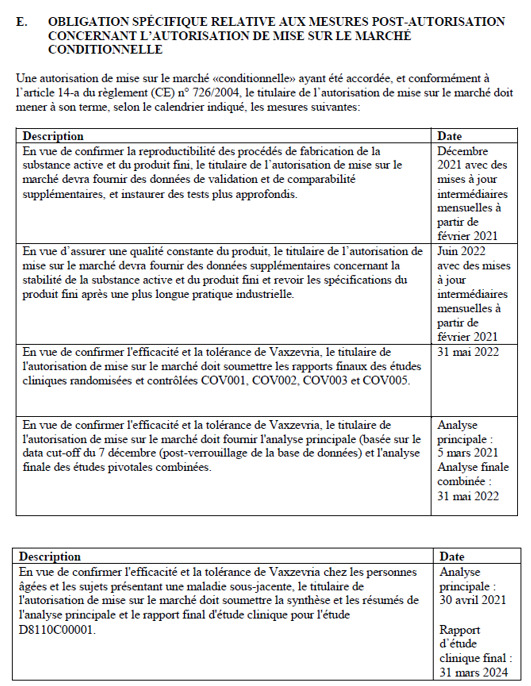
Taulukko 4: Janssenin myyntiluvan liite IIE, sivu 18
Taulukko 5: Raskaustiedot Pfizer EPAR:sta, esimerkkinä
Termi ”raskaana” tai ”raskaus” esiintyi EMA: n julkaisemassa EPAR-raportissa 10 sivulla . Raportin tarkat lauseet näkyvät sellaisina kuin ne ovat tässä taulukossa.
Extracts from the Pfizer EPAR – original text in English French translation by Deepl software Page 14. A study in pregnant women is also planned in the EU. A Post-Approval Active Surveillance Safety Study to Monitor Real-World Safety of Comirnaty (Study C4591010) will be conducted in the EU using primary data collection that monitors a cohort of vaccinees and evaluates risk of AESIs (adverse event of special interest) Sivu 14. Raskaana oleville naisille on suunnitteilla tutkimus myös EU: ssa. Hyväksynnän jälkeinen aktiivisen valvonnan turvallisuustutkimus Comirnatyn todellisen turvallisuuden seuraamiseksi (tutkimus C4591010) suoritetaan EU:ssa ensisijaisen tiedonkeruun avulla, joka seuraa rokotettujen kohorttia ja arvioi AESI-tautien (erityistä kiinnostusta aiheuttavan haittatapahtuman) riskiä. Page 68. 2.5.2. Main study, Title of study: Study C4951001: A Phase 1/2/3, Placebo-Controlled, Randomized, Observer-Blind, Dose-Finding Study to Evaluate the Safety, Tolerability, Immunogenicity, and Efficacy of SARS-COV-2 RNA Vaccine Candidates Against COVID-19 in Healthy Individuals Methods: Study Participants – exclusion criteria – Women who are pregnant or breastfeeding. Sivu 68. 2.5.2. Päätutkimus, tutkimuksen nimi: Tutkimus C4951001: Vaihe 1/2/3, lumelääkekontrolloitu, satunnaistettu, tarkkailija-sokea, annoshakututkimus SARS-COV-2-RNA-rokotteidenn turvallisuuden, siedettävyyden, immunogeenisuuden ja tehokkuuden arvioimiseksi terveillä henkilöillä COVID-19:a vastaan Menetelmät: Tutkimuksen osallistujat – poissulkemisperusteet – Raskaana olevat tai imettävät naiset. Page 93. Immunocompromised subjects and pregnant or breastfeeding women were excluded from the study. Sivu 93. Immuunipuutteiset potilaat ja raskaana olevat tai imettävät naiset suljettiin pois tutkimuksesta. Page 109. At the time of the data cut-off in the Phase 2/3 study (14 Nov 2020), a total of 23 participants had reported pregnancies in the safety database, including 9 participants who withdrew from the vaccination period of the study due to pregnancy. These participants are being followed for pregnancy outcomes. Thus, data on pregnancy are very limited at this stage. Sivu 109. Vaiheen 2/3 tutkimuksen tietojen katkaisuhetkellä (14. marraskuuta 2020) yhteensä 23 osallistujaa ilmoitti raskauksista turvallisuustietokannassa, mukaan lukien 9 osallistujaa, jotka vetäytyivät tutkimuksen rokotusjaksosta. raskauden vuoksi. Näitä osallistujia seurataan raskaustulosten suhteen. Siksi tiedot raskaudesta ovat tässä vaiheessa hyvin rajalliset. Page 113. 23 participants reported pregnancies in the safety database, nine of them were withdrawn from the study due to the pregnancy status. These participants will be followed up for pregnancy outcomes. Sivu 113. 23 osallistujaa ilmoitti raskauksista turvallisuustietokannassa, joista yhdeksän jätettiin pois tutkimuksesta raskaustilan vuoksi. Näitä osallistujia seurataan raskaustulosten suhteen. Page 114. clinical safety: Long term safety data, interaction with other vaccines, data on use in pregnancy and other subgroups (eg frail subjects, or subjects with pre-existing autoimmune diseases) are missing at this stage. Sivu 114. kliininen turvallisuus: Pitkäaikaiset turvallisuustiedot, yhteisvaikutus muiden rokotteiden kanssa, tiedot raskauden ja muiden alaryhmien käytöstä (esim. heikot tai koehenkilöt, joilla on jo autoimmuunisairauksia) puuttuvat tässä vaiheessa. Page 115. safety information: missing information = Use during pregnancy and while breast feeding Sivu 115. Turvallisuustiedot: puuttuvat tiedot = Käyttö raskauden ja imetyksen aikana Page 119. atypical COVID-19 in a cohort of people within the Department of Defense Healthcare System. For December 2023 Sivu 119. epätyypillinen COVID-19 puolustusministeriön terveydenhuoltojärjestelmän ihmisten joukossa. Joulukuussa 2023 Page 120. Study ( study short name, and title) Status (planned / on-going) : C4591015 Planned Summary of Objectives Planned clinical study to assess safety and immunogenicity in pregnant women who receive COVID-19 mRNA vaccine. Safety and immunogenicity of COVID-19 mRNA vaccine in pregnant women Safety concerns addressed: Use in pregnancy and while breast feeding. Protocol draft submission: 28-Feb-2021 Final CSR (Clinical study report) submission: 30-Apr-2023 Sivu 120. Tutkimus (tutkimuksen lyhyt nimi ja nimi) Status (suunniteltu / meneillään): C4591015 – tutkimus suunniteltu (ei vielä suoritettu) Yhteenveto tavoitteista: Suunniteltu kliininen tutkimus turvallisuuden ja immunogeenisuuden arvioimiseksi raskaana oleville naisille, jotka saavat COVID-19-mRNA-rokotetta. COVID-19-mRNA-rokotteen turvallisuus ja immunogeenisuus raskaana oleville naisille. Käsiteltyjä turvallisuuskysymyksiä: Käyttö raskauden ja imetyksen aikana. Protokollaluonnoksen toimittaminen: 28. helmikuuta-2021 Kliinisen tutkimusraportin lopullinen toimittaminen : 30. huhtikuuta-2023 Page 120. Study ( study short name, and title) Status (planned / on-going) : ACCESS / VAC4EU Planned Summary of Objectives Assessment of occurrence of safety events of interest, including severe or atypical COVID-19 in real-world use of COVID-19 mRNA vaccine. Safety concerns addressed: Anaphylaxis AESI-based safety events of interest including vaccine associated enhanced disease Use in pregnancy Use in immunocompromised patients Use in frail patients with co-morbidities (eg, chronic obstructive pulmonary disease (COPD), diabetes, chronic neurological disease, cardiovascular disorders) Use in patients with autoimmune or inflammatory disorders Protocol draft submission: 28-Feb-2021 Final CSR submission: 31-Jan-2024 Sivu 120. Tutkimus (tutkimuksen lyhyt nimi ja nimi) Status (suunniteltu / käynnissä): ACCESS / VAC4EU suunniteltu (ei vielä toteutettu) Yhteenveto tavoitteista Arvio kiinnostavien turvallisuustapahtumien esiintymisestä, mukaan lukien vaikea tai epätyypillinen COVID-19 COVID-19-mRNA-rokotteen tosiasiallisessa käytössä. Käsitellyt turvallisuuskysymykset: Anafylaksia Kiinnostavat turvallisuustapahtumat, jotka perustuvat erityisen kiinnostaviin haittatapahtumiin, mukaan lukien rokotteeseen liittyvät lisääntyneet sairaudet. Käytä raskauden aikana Käyttö immuunipuutteisilla potilailla Käyttö heikoilla potilailla, joilla on samanaikaisia sairauksia (esim. Krooninen obstruktiivinen keuhkosairaus (COPD), diabetes, krooninen neurologinen sairaus, sydän- ja verisuonisairaudet) Käyttö potilaille, joilla on autoimmuuni- tai tulehdussairaus. Pöytäkirjaluonnoksen toimittaminen : 28. helmikuuta 2021 Kliinisen tutkimusraportin lopullinen toimittaminen : 31. tammikuuta-2024 Page 136. Benefit-risk assessment and discussion 3.7.1. Importance of favorable and unfavorable effects There are no data on use in pregnant women, but a protective effect is anticipated. In the light of the reassuring data from the DART study, noting that pregnancy as such is a risk factor for severe COVID-19, and that pregnant women may additionally belong to other risk groups, vaccination may be considered on a case by case basis. Sivu 136. Hyöty-riskiarviointi ja keskustelu 3.7.1. Suotuisien ja epäedullisten vaikutusten merkitys Ei ole tietoa käytöstä raskaana oleville naisille, mutta suojaavan vaikutuksen odotetaan olevan. DART-tutkimuksen rauhoittavien tietojen valossa, jossa todetaan, että raskaus sinänsä on vakavan COVID-19:n riskitekijä ja että raskaana olevat naiset voivat lisäksi kuulua muihin riskiryhmiin, rokotuksia voidaan harkita tapauskohtaisesti.
Liite 6. Internetissä saatavilla olevat viitteet (ei tyhjentävä luettelo)
Aiheesta on olemassa suuri määrä erittäin mielenkiintoisia asiakirjoja:
Euroopan lääkevirasto (EMA): https://europa.eu/european-union/about-eu/agencies/ema_fr
Kansallinen lääkkeiden ja terveystuotteiden turvallisuusvirasto (ANSM): https://ansm.sante.fr/qui-sommes-nous/
Kysymykset ja vastaukset: Ehdollinen myyntilupa COVID-19-rokotteille EU:ssa: https://ec.europa.eu/commission/presscorner/detail/en/QANDA_20_2390
https://www.ema.europa.eu/en/news/meeting-highlights-pharmacovigilance-risk-assessment-committee-prac-8-11-march-2021
Asiakirjat Pfizer Moderna AstraZeneca Janssen Tiedot ovat saatavilla ilmaiseksi EMA: n kautta https://www.ema.europa.eu/en/medicines/human/EPAR/comirnaty https://www.ema.europa.eu/en/medicines/human/EPAR/covid-19-vaccine-moderna https://www.ema.europa.eu/en/medicines/human/EPAR/covid-19-vaccine-astrazeneca https://www.ema.europa.eu/en/medicines/human/EPAR/covid-19-vaccine-janssen Myyntiluvan liitteet https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_fr.pdf https://www.ema.europa.eu/fi/documents/product-information/covid-19-vaccine-moderna-epar-product-information_fr.pdf https://www.ema.europa.eu/fi/documents/product-information/vaxzevria-previously-covid-19-vaccine-astrazeneca-epar-product-information_fr.pdf https://www.ema.europa.eu/fi/documents/product-information/covid-19-vaccine-janssen-epar-product-information_fr.pdf EPAR-arviointikertomus – lääkärintarkastus https://www.ema.europa.eu/fi/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf https://www.ema.europa.eu/fi/documents/assessment-report/covid-19-vaccine-moderna-epar-public-assessment-report_en.pdf https://www.ema.europa.eu/en/documents/overview/covid-19-vaccine-astrazeneca-epar-medicine-overview_fr.pdf https://www.ema.europa.eu/fi/documents/assessment-report/covid-19-vaccine-janssen-epar-public-assessment-report_en.pdf Yhteenveto lääkevalmistekomitean myönteisestä lausunnosta https://www.ema.europa.eu/en/documents/smop-initial/chmp-summary-positive-opinion-comirnaty_en.pdf https://www.ema.europa.eu/fi/documents/smop-initial/chmp-summary-positive-opinion-covid-19-vaccine-moderna_en.pdf https://www.ema.europa.eu/fi/documents/smop-initial/chmp-summary-positive-opinion-covid-19-vaccine-astrazeneca_en.pdf https://www.ema.europa.eu/fi/documents/smop-initial/chmp-summary-positive-opinion-covid-19-vaccine-janssen_en.pdf Riskienhallintasuunnitelma https://www.ema.europa.eu/en/documents/rmp-summary/comirnaty-epar-risk-management-plan_en.pdf https://www.ema.europa.eu/fi/documents/rmp-summary/covid-19-vaccine-moderna-epar-risk-management-plan_en.pdf https://www.ema.europa.eu/fi/documents/rmp-summary/covid-19-vaccine-astrazeneca-epar-risk-management-plan_en.pdf https://www.ema.europa.eu/documents/rmp-summary/covid-19-vaccine-janssen-epar-risk-management-plan_en.pdf
Tämä artikkeli lähetettiin myös:
https://www.linkedin.com/posts/catherinefrade_%C3%A9clairage-sur-les-donn%C3%A9es-publiques-europ%C3%A9ennes-activity-6783385465841082368-KqWr Blogissani täällä: http://www.catherinefrade.com/blog/2021/04/01/ecclairage-sur-les-donnees-publiques-europeennes-des-amm-conditionnelles-pour-les-4-vaccins-covid -19-31-maaliskuu-2021 / Artiklan 2 mukaan Choletin sairaalan CTIAP on 2. huhtikuuta 2021: http://ctiapchcholet.blogspot.com/2021/04/inedit-exclusif-vaccins-contre-la-covid.html 3 artikla, joka on yhdenmukainen oikeusvaikutuksia koskevan 1 artiklan kanssa: https://www.linkedin.com/posts/catherinefrade_vaccins-covid19-vaccination-activity-6785286370953895936-TqHn Eri verkkosivustojen välittämä 1 artikla: https://www.medias-presse.info/doute-sur-la-qualite-intrinseque-des-produits-presentes-comme-vaccins-anti-covid-et-leurs-procedes-de-fabrication-sur-base- virallisten asiakirjojen julkaisema-Euroopan-lääkeviraston / 141451 / saksaksi: Zweifel an der intrinsischen Qualität von Produkten, die als Anti-Covid-Impfstoffe präsentiert werden | MITTELEUROPAN ALALLA https://www.linkedin.com/posts/chantalattia_ces-vaccins-sont-une-exp%C3%A9rimentation-d%C3%A9lai-activity-6784593281922695168-u10g
Jos tiedät muita artikkelin loppuosia, ilmoita minulle, että voin myös jakaa. Ota yhteyttä saadaksesi lisätietoja virallisten julkisten tietojen tulkinnasta.
Lähde:
https://kapitaali.com/neljan-covid-rokotteen-euroopassa-julkisesti-saatavilla-olevan-datan-tarkastelua-30-3-2021/
0 notes
Text
Miss Suomi 2022 results: Essi Unkuri crowns successor in Kerava, Uusimaa, Finland
Miss Suomi 2022 results: Essi Unkuri crowns successor in Kerava, Uusimaa, Finland
beauty pageant: Miss Suomiedition: 91stinternational memberships: Miss Universe, Miss World, Miss Internationaldate: September 17, 2022venue: AlfaTV, Kerava, Uusimaa, Finlandbroadcaster: AlfaTVhosts: performers: candidates: 20
.
CANDIDATES
PLACEMENTCANDIDATESTop 20Ella Kangas, 21, TurkuElla Lännistö, 21, TurkuEmmi Pekkanen, 23, LahtiHenrika Päkkilä, 25, OuluJenina Rautionaho, 24, TampereJenna…

View On WordPress
0 notes
Text
Miss Suomi 2022 results: Essi Unkuri's successor crowned in Kerava, Uusimaa, Finland
Miss Suomi 2022 results: Essi Unkuri’s successor crowned in Kerava, Uusimaa, Finland
beauty pageant: Miss Suomiedition: 91stinternational memberships: Miss Universe, Miss World, Miss Internationaldate: September 17, 2022venue: AlfaTV, Kerava, Uusimaa, Finlandbroadcaster: AlfaTVhosts: performers: candidates: 20
.
RESULTS
PLACEMENTCANDIDATESMiss Suomi 2022Miss Universe Finland 2022Miss World Finland 2022Miss International Finland 20221st runner-up2nd runner-upTop 10Adelaide…

View On WordPress
0 notes
Text
5 most beautiful Miss Suomi 2022 candidates
5 most beautiful Miss Suomi 2022 candidates
Miss Suomi 2021 Essi Unkuri of Vaasa, Ostrobothnia, Finland will crown her successor on September 17, 2022. It is the 91st edition of the national beauty pageant that selects Finland’s Miss Universe candidate.
Currently, Finland has 18 Miss Universe placements including the coronation of Armi Kuusela in 1952 and Anne Marie Pohtamo in 1975. Kuusela is the first ever Miss…

View On WordPress
0 notes
Text
Miss Suomi 2023 predictions: Jenna Rintamäki, Maisa Alatalo, Anni Seppänen
The Miss Suomi 2023 coronation ceremony will be held at the Aino Areena in Järvenpää, Uusimaa, Finland on September 9, 2023. It is the 92nd edition of the national beauty pageant that selects Finland’s Miss Universe, Miss World and Miss International candidates.
On September 17, 2022, Petra Hämäläinen of Savonlinna was crowned Miss Suomi 2022 at Valkoinen Sali in Helsinki, Finland. Nana Partanen…

View On WordPress
#Anni Seppänen#Finnish beauty pageants#Finnish beauty queens#Jenna Rintamäki#Maisa Alatalo#Miss Suomi
0 notes
Text
5 most beautiful Miss Suomi 2023 candidates
The Miss Suomi 2023 coronation ceremony will be held at the Aino Areena in Järvenpää, Uusimaa, Finland on September 9, 2023. It is the 92nd edition of the national beauty pageant that selects Finland’s Miss Universe, Miss World and Miss International candidates.
On September 17, 2022, Petra Hämäläinen of Savonlinna was crowned Miss Suomi 2022 at Valkoinen Sali in Helsinki, Finland. Nana Partanen…

View On WordPress
#Finnish beauty pageants#Finnish beauty queens#Miss International#Miss Suomi#Miss Universe#Miss World
0 notes
Photo
Neljän COVID-rokotteen Euroopassa julkisesti saatavilla olevan datan tarkastelua (30.3.2021)


Kirjoittanut: Catherine FRADE
Julkaistu: 1. huhtikuuta 2021

Lääketieteen tohtorina, entisenä lääketeollisuuden kansainvälisen sääntelyn johtajana haluan valaista ymmärrystänne virallisista tiedoista koskien neljää COVID-19 -rokotetta. Kaikki alla esitetyt tiedot on ladattavissa tästä linkistä. Olin innostunut työstäni laillisten tekstien kenttätutkimuksessa, jotta osaisin kehittää parhaiten lääkkeitä ja työskennellä synergiassa yrityksen ja terveysviranomaisten eri osastojen kanssa Ranskassa ja ulkomailla (jopa 83 maahan). 30. maaliskuuta 2021 Pfizer-, Moderna-, Astra Zeneca- ja Janssen-laboratoriot ovat saaneet ehdollisen myyntiluvan 4: lle COVID-19-rokotteelle (joulukuun 2020 ja maaliskuun 2021 välillä). Nykytilanteen ymmärtämiseksi on välttämätöntä käyttää lähdetietoja, kentällä toimimattoman henkilön on vaikea tunnistaa. Tämän artikkelin tarkoituksena on siis valaista julkista tietoa näistä neljästä COVID-19-rokotteesta viittaamalla kuhunkin lähteeseen, jotta niiden aitous voidaan vahvistaa. Tästä syystä löydät tästä artikkelista linkit myyntilupien virallisiin asiakirjoihin ja yhteenvedot Euroopan lääkeviraston (EMA) arvioimista tieteellisistä tutkimuksista .
Ensinnäkin haluan selventää, että minulla ei ole eturistiriitoja lääketeollisuuden kanssa.
1. Ensinnäkin on tärkeää tietää, mikä ehdollinen myyntilupa on:
Myyntilupa (Marketing Authorization, MA/ML) myönnetään, kun tuote on osoittanut laadun, tehokkuuden ja turvallisuuden positiivisella hyöty-riskisuhteella (eli että sillä on enemmän hyötyjä kuin riskejä). Myyntiluvan saaminen on edellytys lääkkeen, mukaan lukien rokotteet, myymiselle. Kaikki MA-hakemuksen aikana tehdyt tutkimukset on tiivistetty EPAR-lausekkeeseen (= European Public Assessment Report). Se julkaistaan Euroopan lääkeviraston (EMA) verkkosivustolla. Mukana ovat myös suunnitellut tutkimukset, joita ei ole vielä tehty. Tämä aikataulu, joka kestää vuodet 2021-2025 COVID-19-rokotteesta riippuen, on määritelty ehdollisen myyntiluvan liitteissä ja EPAR-lausunnossa. Myyntilupa myönnetään myyntiluvan haltijalle (Marketing Authorization Holder, MAH). Ehdolliset myyntiluvat saatiin laadun, kliinisen ja ei-kliinisen tiedon perusteella rokotetestistä ja/tai bibliografisesta kirjallisuudesta. Bibliografisen kirjallisuuden tiedot ovat tunnustetuissa tieteellisissä lehdissä julkaistuja tutkimuksia, jotka on kirjoittanut myyntilupaa pyytäneen laboratorioon liittymättömät ja ulkopuoliset ryhmät. Nopeutetulla keskitetyllä menettelyllä saatu eurooppalainen myyntilupa sallii samanaikaisen markkinoinnin seuraavissa 30 maassa (Euroopan unioni ja Euroopan vapaakauppaliitto): Saksa, Itävalta, Belgia, Bulgaria, Kypros, Kroatia, Tanska, Espanja, Viro, Suomi, Ranska, Kreikka, Unkari, Irlanti, Islanti, Italia, Latvia, Liechtenstein, Liettua, Luxemburg, Malta, Norja, Alankomaat, Puola, Portugali, Romania, Slovakia, Slovenia, Ruotsi, Tšekki. Esimerkiksi Pfizerin EPAR (sivut 67 ja 114) päivämäärällä 19. helmikuuta 2021, joka on tähän mennessä eniten käytetty COVID-19-rokote, jolla on laajin käyttöindikaatio (yli 16-vuotiaat), mainitsee että tärkein ns. kliininen tutkimus on vaiheen 1/2/3 tutkimus, joka on edelleen kesken.
Alkuperäinen englanninkielinen EPAR Käännös Study C4951001: A Phase 1/2/3, Placebo-Controlled, Randomized, Observer-Blind, Dose-Finding Study to Evaluate the Safety, Tolerability, Immunogenicity, and Efficacy of SARS-COV-2 RNA Vaccine Candidates Against COVID-19 in Healthy Individuals The safety evaluation is based on one ongoing Phase 2/3 study that at the time of data cut-off (14-Nov-20) included 43,448 subjects who received either two doses of BNT162b2 30μg (n = 21,720) or placebo (n = 21,728). Overall, the reported reactogenicity profile are in line with any authorized vaccine. In addition, the frequency of reported AEs and SAEs were low. The emerging safety profile is presently considered favorable. Long term safety data, interaction with other vaccines, data on use in pregnancy and other subgroups (eg frail subjects, or subjects with pre-existing autoimmune diseases) are missing at this stage. The lack of long-term follow up renders the data provided non-comprehensive. Therefore, the delivery of the final C4951001 study report, including a 2-year follow up of the studied population, is classified as a specific obligation in the context of a conditional marketing authorization. The plan for the generation of further safety data post authorization is described in the section below. Tutkimus C4951001: Vaihe 1/2/3, lumekontrolloitu, satunnaistettu, tarkkailija-sokea, annosmääritystutkimus rokottajaehdokkaiden turvallisuuden, siedettävyyden, immunogeenisuuden ja tehokkuuden arvioimiseksi SARS-COV-2-RNA-rokotteelle COVID-19:a vastaan terveillä yksilöillä. (sivu 67) Turvallisuusarviointi perustuu käynnissä olevaan vaiheen 2/3 tutkimukseen, johon tietojen sulkemishetkellä (14.-20.11.) osallistui 43 448 potilasta, jotka saivat joko kaksi 30 μg: n annosta (n = 21 720) tai lumelääkettä (n = 21 728). Ilmoitettu reaktogeenisuusprofiili on kaiken kaikkiaan yhdenmukainen minkä tahansa lisensoidun rokotteen kanssa. Lisäksi ilmoitettujen haittavaikutusten ja vakavien haittavaikutusten esiintymistiheys oli pieni. Uusia turvallisuusprofiileja pidetään tällä hetkellä suotuisina. Pitkäaikaiset turvallisuustiedot, vuorovaikutus muiden rokotteiden kanssa, tiedot käytöstä raskauden aikana ja muut alaryhmät (esimerkiksi heikot tai koehenkilöt, joilla on jo autoimmuunisairauksia) puuttuvat tässä vaiheessa. Pitkän aikavälin seurannan puuttuminen tekee toimitetuista tiedoista tyhjentäviä. Siksi tutkimuksen C4951001 loppuraportin toimittaminen, mukaan lukien tutkimusväestön kahden vuoden seuranta, luokitellaan erityiseksi velvoitteeksi ehdollisen myyntiluvan yhteydessä. Suunnitelma ylimääräisten suojaustietojen tuottamiseksi valtuutuksen jälkeen on kuvattu alla olevassa osassa.
2. Yhteenvetotaulukko EMA:n verkkosivustolla julkaistusta neljän COVID-19-rokotteen myyntiluvasta:
Rekisteröintimenettelyn etenemisestä ja vielä toimitettavista tutkimuksista on oltava näkyvyys. Alla olevassa taulukossa on esitetty viralliset julkiset tiedot EMA-sivustolta: Nämä tiedot on otettu virallisista teksteistä 22. maaliskuuta 2021 (Alleviivatut tekstit viittaavat vastaaviin linkkeihin EMA:n virallisilla verkkosivuilla ja kaikki linkit on tiivistetty tämän asiakirjan loppuun).
Myyntiluvan haltijat (= MAH) BioNTech / Pfizer Moderna Biotech Astra Zeneca Janssen Päivämäärä, jolloin saatiin mahdollisuus hakea eurooppalaista myyntilupaa (kelpoisuuspäivä) 23. heinäkuuta 2020 12. lokakuuta 2020 9. kesäkuuta 2020 28. heinäkuuta 2020 Myyntilupahakemuksen jättöpäivä Euroopan lääkevirastolle 30. marraskuuta 2020 30. marraskuuta 2020 11. tammikuuta 2021 15. helmikuuta 2021 Ehdollisen eurooppalaisen myyntiluvan saamispäivä 21. joulukuuta 2020 6. tammikuuta 2021 29. tammikuuta 2021 11. maaliskuuta 2021 Päiväys, jona myyntiluvan haltijoiden asiakirja-aineistoa koskeva eurooppalainen julkinen arviointiraportti (= EPAR = englanniksi European Public Assessment Report) sisältää yhteenvedon kaikista toimitetuista tutkimuksista laadun, turvallisuuden, suvaitsevaisuuden, tehon ja hyöty-riskisuhteen suhteen. 23. joulukuuta 2020 Käytetty versio: 19.02.2021 (140 sivua) 20. tammikuuta 2021 Käytetty versio: 11. maaliskuuta 2021 (169 sivua ) 29. tammikuuta 2021 Käytetty versio: 181 sivua 11. maaliskuuta 2021 Käytetty versio (218 sivua) Riskienhallintasuunnitelman raportin päivämäärä 23. joulukuuta 2020 (114 sivua) 20. tammikuuta 2021 (95 sivua) 18. helmikuuta 2021 (106 sivua) 11. maaliskuuta 2021 (103 sivua) Lisätutkimukset toimitetaan Euroopan myyntiluvan liitteiden vaatimusten mukaisesti Katso alla oleva taulukko 1 Katso alla oleva taulukko 2 Katso alla oleva taulukko 3 Katso alla oleva taulukko 4 Määräaika tehoaineen ja lopputuotteen laatua koskevan lisätodistuksen toimittamiseksi Heinäkuu 2021 Huomaa: 2 uuden apuaineen käyttö Kesäkuu 2021 Huomaa: 2 uuden apuaineen käyttö Joulukuu 2021 Elokuu 2021 Määräaika rokotteen tehokkuuden, turvallisuuden ja sietokyvyn vahvistamisen toimittamiselle Joulukuu 2023 Joulukuu 2022 kesäkuuhun 2025 (vrt. EPAR s. 134, 139) Toukokuu 2022 (pääanalyysi) Maaliskuu 2024 (vanhukset ja perussairaus) Joulukuu 2023
3. Näiden julkisten tietojen analyysistä käy ilmi, että:
Nämä rokotteet ovat saaneet ehdollisen myyntiluvan, joka on voimassa yhden vuoden tavallisten myyntilupien viiden vuoden sijaan. Käynnissä olevat ja suunnitellut tutkimukset on saatava päätökseen, jotta voidaan hankkia vakiomuotoinen MA.
Vaikka kliiniset tutkimukset on suunniteltu alkavaksi, ne eivät ole täydellisiä, ja jotkut eivät ole vielä alkaneet. Rokotteesta riippuen lopulliset määräajat suunnitellaan vuosien 2022 ja 2025 välille (katso yllä oleva taulukko).
Yhden laboratorion COVID-19- rokotteen vaihdettavuudesta muiden laboratorioiden muiden COVID-19-rokotteiden kanssa rokotusaikataulun täyttämiseksi ei ole tietoa.
Käyttö rokote on tarkoitettu 18-vuotiaille , paitsi että Pfizerin ilmoitettu ikä on 16-vuotiaasta.
”Rokotteiden turvallisuutta ja tehoa lapsilla ja alle 18-vuotiailla nuorilla ei ole vielä varmistettu.” Tämä koskee Modernaa, Astra-Zenecaa ja Janssenia, joista ” tietoja ei ole saatavilla”. Sama Pfizerin tapauksessa ”lapsilla ja alle 16-vuotiailla nuorilla, joiden tietoja on rajoitetusti”.
Tietoa raskaana olevista naisista on hyvin rajallisesti (hylkäämiskriteerejä kliinisistä tutkimuksista): vähän tai ei lainkaan tietoa turvallisuudesta ja tehosta on toistaiseksi tiedossa. ( Taulukko 5 esimerkkinä). Raskaana olevien naisten rokottamista voidaan harkita vain tapauskohtaisesti. Pfizer-, Moderna- ja Janssen-rokotteiden osalta myyntiluvan liitteessä I esitetyssä tieteellisessä esitteessä (valmisteyhteenveto) ilmoitetaan, että Rokotteen käytöstä raskaana oleville naisille on vain vähän tietoja. Eläinkokeet eivät ole tuottaneet suoria tai epäsuoria haitallisia vaikutuksia raskauteen, alkion/sikiön kehitykseen, synnytykseen tai postnataaliseen kehitykseen (ks. AMM: n liitteessä I oleva 5.3 kohta). Käyttöä raskaana oleville naisille tulee harkita vain, jos mahdolliset hyödyt ovat suuremmat kuin mahdolliset riskit äidille ja sikiölle . ” Astra Zenecan pakkausselosteessa ei mainita vastaavia tietoja: ”Jos olet raskaana tai imetät, epäilet olevasi raskaana tai suunnittelet lapsen hankkimista, kysy neuvoa lääkäriltäsi, apteekista tai sairaanhoitajalta rokotteen ottamiseksi.”
Kokemuksen perusteella mikä tahansa markkinoille saatettu lääke antaa mahdollisuuden tuoda esiin laajamittaisia haittavaikutuksia, joita ei ole esiintynyt tai on harvoin esiintynyt kliinisissä tutkimuksissa. Tämä tarkoittaa konkreettisesti, että rokotuksiin liittyvät haittavaikutukset voivat ilmetä ajan myötä (mikä todennäköisesti selittää Astra-Zeneca-jakson maaliskuun puolivälissä 2021).
Nopeutetun keskitetyn eurooppalaisen menettelyn mukainen rokotteiden ehdollinen myyntilupa ”annettiin kansanterveyden eduksi täyttämään lääketieteellinen tarve”.
Jotkut professorit ja lääkärit ilmoittivat havainneensa alalla lääkeyhdistelmistä muodostettujen hoitojen tehokkuuden: viruslääkkeet, antibiootit, vitamiinit, ravintolisät jne. Tiedämme sen jälkeen tieteellisten julkaisujen erilaisesta kohtelusta käydyn keskustelun, joka voisi olla oikeudellisesti hyväksyttävää uusien rokotteiden ehdollisen myyntilupahakemuksen yhteydessä ja jota ei voida hyväksyä monien vuosien ajan käytettyjen lääkkeiden käytöstä (vrt. hydroksiklorokiini) …Jopa nykypäivänä asiasta edelleen debatoidaan.
Johtopäätös
Yhteenvetona voidaan todeta, että 30 maassa epätäydellisten ja/tai bibliografisten tutkimusten ja tulevien tutkimusten perusteella saatu ehdollinen eurooppalainen myyntilupa antaa ymmärtää, miten COVID-19-rokotteen antaminen vuonna 2021 on laajamittaisesti tutkittu. Ihmiset, jotka on rokotettu osana vielä kesken olevia tai tulevia tutkimuksia (kuten lapset, raskaana olevat naiset ja kaikki EPAR-taulukoissa esitetyt taulukot), joutuvat siksi kokeellisten tutkimus- ja kehitysprotokollien alaisiksi. Jokaisella on ennen rokotusta oikeus pyytää kaikki tietoisen suostumuksensa kannalta hyödylliset tiedot, mukaan lukien lääkityksen ohjeet (katso myyntiluvan liitteet, linkit tämän asiakirjan lopussa olevaan liitteeseen 6. Asiakirjat). Lisäksi ennalta varautumisen periaatteen on oltava vallitseva jo ennen mainitun suostumuksen saamista.

Tänään olen suuntautunut ammatillisessa toiminnassani ihmisten ja organisaatioiden terveyden ja elämänlaadun tukemiseen ja kouluttamiseen heidän tarkoituksensa mukaisesti, ja olen hyvin kiintynyt kaikkien kunnioittamiseen. Farmasian tohtorina ja kokonaisvaltaisena työpsykologina (CV liitteenä) yhdistän rationaaliset tieteet tietoisuuden tulokulmiin kaikissa muodoissaan. Näiden dokumentti- ja sääntelylähteiden tuella halusin antaa sinun löytää itsellesi hyvän ymmärryksen teksteistä ja siten valaista näitä uusia rokotteita. Dr. Catherine FRADE, ansioluettelo löytyy tästä. Farmasian tohtori, psykologi ja työpsykopatologi
Taulukko 1: Pfizer-myyntiluvan liite IIE, sivut 18 ja 19

Taulukko 2: Modernan myyntiluvan liite IIE, sivu 15
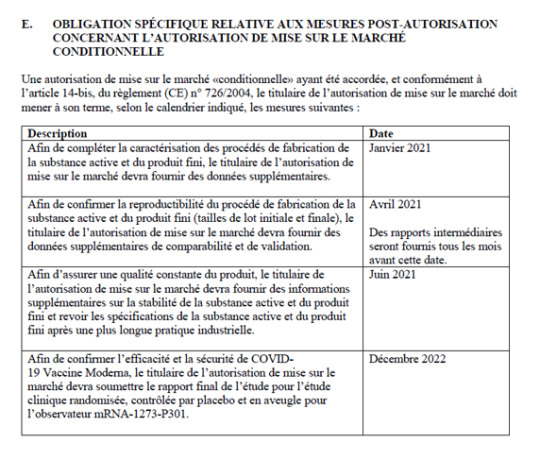
Taulukko 3: Astra Zenecan myyntiluvan liite IIE, sivut 14 ja 15
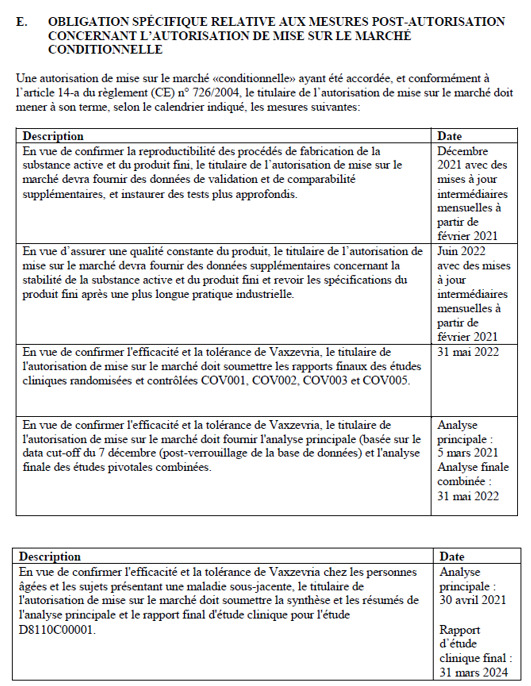
Taulukko 4: Janssenin myyntiluvan liite IIE, sivu 18
Taulukko 5: Raskaustiedot Pfizer EPAR:sta, esimerkkinä
Termi ”raskaana” tai ”raskaus” esiintyi EMA: n julkaisemassa EPAR-raportissa 10 sivulla . Raportin tarkat lauseet näkyvät sellaisina kuin ne ovat tässä taulukossa.
Extracts from the Pfizer EPAR – original text in English French translation by Deepl software Page 14. A study in pregnant women is also planned in the EU. A Post-Approval Active Surveillance Safety Study to Monitor Real-World Safety of Comirnaty (Study C4591010) will be conducted in the EU using primary data collection that monitors a cohort of vaccinees and evaluates risk of AESIs (adverse event of special interest) Sivu 14. Raskaana oleville naisille on suunnitteilla tutkimus myös EU: ssa. Hyväksynnän jälkeinen aktiivisen valvonnan turvallisuustutkimus Comirnatyn todellisen turvallisuuden seuraamiseksi (tutkimus C4591010) suoritetaan EU:ssa ensisijaisen tiedonkeruun avulla, joka seuraa rokotettujen kohorttia ja arvioi AESI-tautien (erityistä kiinnostusta aiheuttavan haittatapahtuman) riskiä. Page 68. 2.5.2. Main study, Title of study: Study C4951001: A Phase 1/2/3, Placebo-Controlled, Randomized, Observer-Blind, Dose-Finding Study to Evaluate the Safety, Tolerability, Immunogenicity, and Efficacy of SARS-COV-2 RNA Vaccine Candidates Against COVID-19 in Healthy Individuals Methods: Study Participants – exclusion criteria – Women who are pregnant or breastfeeding. Sivu 68. 2.5.2. Päätutkimus, tutkimuksen nimi: Tutkimus C4951001: Vaihe 1/2/3, lumelääkekontrolloitu, satunnaistettu, tarkkailija-sokea, annoshakututkimus SARS-COV-2-RNA-rokotteidenn turvallisuuden, siedettävyyden, immunogeenisuuden ja tehokkuuden arvioimiseksi terveillä henkilöillä COVID-19:a vastaan Menetelmät: Tutkimuksen osallistujat – poissulkemisperusteet – Raskaana olevat tai imettävät naiset. Page 93. Immunocompromised subjects and pregnant or breastfeeding women were excluded from the study. Sivu 93. Immuunipuutteiset potilaat ja raskaana olevat tai imettävät naiset suljettiin pois tutkimuksesta. Page 109. At the time of the data cut-off in the Phase 2/3 study (14 Nov 2020), a total of 23 participants had reported pregnancies in the safety database, including 9 participants who withdrew from the vaccination period of the study due to pregnancy. These participants are being followed for pregnancy outcomes. Thus, data on pregnancy are very limited at this stage. Sivu 109. Vaiheen 2/3 tutkimuksen tietojen katkaisuhetkellä (14. marraskuuta 2020) yhteensä 23 osallistujaa ilmoitti raskauksista turvallisuustietokannassa, mukaan lukien 9 osallistujaa, jotka vetäytyivät tutkimuksen rokotusjaksosta. raskauden vuoksi. Näitä osallistujia seurataan raskaustulosten suhteen. Siksi tiedot raskaudesta ovat tässä vaiheessa hyvin rajalliset. Page 113. 23 participants reported pregnancies in the safety database, nine of them were withdrawn from the study due to the pregnancy status. These participants will be followed up for pregnancy outcomes. Sivu 113. 23 osallistujaa ilmoitti raskauksista turvallisuustietokannassa, joista yhdeksän jätettiin pois tutkimuksesta raskaustilan vuoksi. Näitä osallistujia seurataan raskaustulosten suhteen. Page 114. clinical safety: Long term safety data, interaction with other vaccines, data on use in pregnancy and other subgroups (eg frail subjects, or subjects with pre-existing autoimmune diseases) are missing at this stage. Sivu 114. kliininen turvallisuus: Pitkäaikaiset turvallisuustiedot, yhteisvaikutus muiden rokotteiden kanssa, tiedot raskauden ja muiden alaryhmien käytöstä (esim. heikot tai koehenkilöt, joilla on jo autoimmuunisairauksia) puuttuvat tässä vaiheessa. Page 115. safety information: missing information = Use during pregnancy and while breast feeding Sivu 115. Turvallisuustiedot: puuttuvat tiedot = Käyttö raskauden ja imetyksen aikana Page 119. atypical COVID-19 in a cohort of people within the Department of Defense Healthcare System. For December 2023 Sivu 119. epätyypillinen COVID-19 puolustusministeriön terveydenhuoltojärjestelmän ihmisten joukossa. Joulukuussa 2023 Page 120. Study ( study short name, and title) Status (planned / on-going) : C4591015 Planned Summary of Objectives Planned clinical study to assess safety and immunogenicity in pregnant women who receive COVID-19 mRNA vaccine. Safety and immunogenicity of COVID-19 mRNA vaccine in pregnant women Safety concerns addressed: Use in pregnancy and while breast feeding. Protocol draft submission: 28-Feb-2021 Final CSR (Clinical study report) submission: 30-Apr-2023 Sivu 120. Tutkimus (tutkimuksen lyhyt nimi ja nimi) Status (suunniteltu / meneillään): C4591015 – tutkimus suunniteltu (ei vielä suoritettu) Yhteenveto tavoitteista: Suunniteltu kliininen tutkimus turvallisuuden ja immunogeenisuuden arvioimiseksi raskaana oleville naisille, jotka saavat COVID-19-mRNA-rokotetta. COVID-19-mRNA-rokotteen turvallisuus ja immunogeenisuus raskaana oleville naisille. Käsiteltyjä turvallisuuskysymyksiä: Käyttö raskauden ja imetyksen aikana. Protokollaluonnoksen toimittaminen: 28. helmikuuta-2021 Kliinisen tutkimusraportin lopullinen toimittaminen : 30. huhtikuuta-2023 Page 120. Study ( study short name, and title) Status (planned / on-going) : ACCESS / VAC4EU Planned Summary of Objectives Assessment of occurrence of safety events of interest, including severe or atypical COVID-19 in real-world use of COVID-19 mRNA vaccine. Safety concerns addressed: Anaphylaxis AESI-based safety events of interest including vaccine associated enhanced disease Use in pregnancy Use in immunocompromised patients Use in frail patients with co-morbidities (eg, chronic obstructive pulmonary disease (COPD), diabetes, chronic neurological disease, cardiovascular disorders) Use in patients with autoimmune or inflammatory disorders Protocol draft submission: 28-Feb-2021 Final CSR submission: 31-Jan-2024 Sivu 120. Tutkimus (tutkimuksen lyhyt nimi ja nimi) Status (suunniteltu / käynnissä): ACCESS / VAC4EU suunniteltu (ei vielä toteutettu) Yhteenveto tavoitteista Arvio kiinnostavien turvallisuustapahtumien esiintymisestä, mukaan lukien vaikea tai epätyypillinen COVID-19 COVID-19-mRNA-rokotteen tosiasiallisessa käytössä. Käsitellyt turvallisuuskysymykset: Anafylaksia Kiinnostavat turvallisuustapahtumat, jotka perustuvat erityisen kiinnostaviin haittatapahtumiin, mukaan lukien rokotteeseen liittyvät lisääntyneet sairaudet. Käytä raskauden aikana Käyttö immuunipuutteisilla potilailla Käyttö heikoilla potilailla, joilla on samanaikaisia sairauksia (esim. Krooninen obstruktiivinen keuhkosairaus (COPD), diabetes, krooninen neurologinen sairaus, sydän- ja verisuonisairaudet) Käyttö potilaille, joilla on autoimmuuni- tai tulehdussairaus. Pöytäkirjaluonnoksen toimittaminen : 28. helmikuuta 2021 Kliinisen tutkimusraportin lopullinen toimittaminen : 31. tammikuuta-2024 Page 136. Benefit-risk assessment and discussion 3.7.1. Importance of favorable and unfavorable effects There are no data on use in pregnant women, but a protective effect is anticipated. In the light of the reassuring data from the DART study, noting that pregnancy as such is a risk factor for severe COVID-19, and that pregnant women may additionally belong to other risk groups, vaccination may be considered on a case by case basis. Sivu 136. Hyöty-riskiarviointi ja keskustelu 3.7.1. Suotuisien ja epäedullisten vaikutusten merkitys Ei ole tietoa käytöstä raskaana oleville naisille, mutta suojaavan vaikutuksen odotetaan olevan. DART-tutkimuksen rauhoittavien tietojen valossa, jossa todetaan, että raskaus sinänsä on vakavan COVID-19:n riskitekijä ja että raskaana olevat naiset voivat lisäksi kuulua muihin riskiryhmiin, rokotuksia voidaan harkita tapauskohtaisesti.
Liite 6. Internetissä saatavilla olevat viitteet (ei tyhjentävä luettelo)
Aiheesta on olemassa suuri määrä erittäin mielenkiintoisia asiakirjoja:
Euroopan lääkevirasto (EMA): https://europa.eu/european-union/about-eu/agencies/ema_fr
Kansallinen lääkkeiden ja terveystuotteiden turvallisuusvirasto (ANSM): https://ansm.sante.fr/qui-sommes-nous/
Kysymykset ja vastaukset: Ehdollinen myyntilupa COVID-19-rokotteille EU:ssa: https://ec.europa.eu/commission/presscorner/detail/en/QANDA_20_2390
https://www.ema.europa.eu/en/news/meeting-highlights-pharmacovigilance-risk-assessment-committee-prac-8-11-march-2021
Asiakirjat Pfizer Moderna AstraZeneca Janssen Tiedot ovat saatavilla ilmaiseksi EMA: n kautta https://www.ema.europa.eu/en/medicines/human/EPAR/comirnaty https://www.ema.europa.eu/en/medicines/human/EPAR/covid-19-vaccine-moderna https://www.ema.europa.eu/en/medicines/human/EPAR/covid-19-vaccine-astrazeneca https://www.ema.europa.eu/en/medicines/human/EPAR/covid-19-vaccine-janssen Myyntiluvan liitteet https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_fr.pdf https://www.ema.europa.eu/fi/documents/product-information/covid-19-vaccine-moderna-epar-product-information_fr.pdf https://www.ema.europa.eu/fi/documents/product-information/vaxzevria-previously-covid-19-vaccine-astrazeneca-epar-product-information_fr.pdf https://www.ema.europa.eu/fi/documents/product-information/covid-19-vaccine-janssen-epar-product-information_fr.pdf EPAR-arviointikertomus – lääkärintarkastus https://www.ema.europa.eu/fi/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf https://www.ema.europa.eu/fi/documents/assessment-report/covid-19-vaccine-moderna-epar-public-assessment-report_en.pdf https://www.ema.europa.eu/en/documents/overview/covid-19-vaccine-astrazeneca-epar-medicine-overview_fr.pdf https://www.ema.europa.eu/fi/documents/assessment-report/covid-19-vaccine-janssen-epar-public-assessment-report_en.pdf Yhteenveto lääkevalmistekomitean myönteisestä lausunnosta https://www.ema.europa.eu/en/documents/smop-initial/chmp-summary-positive-opinion-comirnaty_en.pdf https://www.ema.europa.eu/fi/documents/smop-initial/chmp-summary-positive-opinion-covid-19-vaccine-moderna_en.pdf https://www.ema.europa.eu/fi/documents/smop-initial/chmp-summary-positive-opinion-covid-19-vaccine-astrazeneca_en.pdf https://www.ema.europa.eu/fi/documents/smop-initial/chmp-summary-positive-opinion-covid-19-vaccine-janssen_en.pdf Riskienhallintasuunnitelma https://www.ema.europa.eu/en/documents/rmp-summary/comirnaty-epar-risk-management-plan_en.pdf https://www.ema.europa.eu/fi/documents/rmp-summary/covid-19-vaccine-moderna-epar-risk-management-plan_en.pdf https://www.ema.europa.eu/fi/documents/rmp-summary/covid-19-vaccine-astrazeneca-epar-risk-management-plan_en.pdf https://www.ema.europa.eu/documents/rmp-summary/covid-19-vaccine-janssen-epar-risk-management-plan_en.pdf
Tämä artikkeli lähetettiin myös:
https://www.linkedin.com/posts/catherinefrade_%C3%A9clairage-sur-les-donn%C3%A9es-publiques-europ%C3%A9ennes-activity-6783385465841082368-KqWr Blogissani täällä: http://www.catherinefrade.com/blog/2021/04/01/ecclairage-sur-les-donnees-publiques-europeennes-des-amm-conditionnelles-pour-les-4-vaccins-covid -19-31-maaliskuu-2021 / Artiklan 2 mukaan Choletin sairaalan CTIAP on 2. huhtikuuta 2021: http://ctiapchcholet.blogspot.com/2021/04/inedit-exclusif-vaccins-contre-la-covid.html 3 artikla, joka on yhdenmukainen oikeusvaikutuksia koskevan 1 artiklan kanssa: https://www.linkedin.com/posts/catherinefrade_vaccins-covid19-vaccination-activity-6785286370953895936-TqHn Eri verkkosivustojen välittämä 1 artikla: https://www.medias-presse.info/doute-sur-la-qualite-intrinseque-des-produits-presentes-comme-vaccins-anti-covid-et-leurs-procedes-de-fabrication-sur-base- virallisten asiakirjojen julkaisema-Euroopan-lääkeviraston / 141451 / saksaksi: Zweifel an der intrinsischen Qualität von Produkten, die als Anti-Covid-Impfstoffe präsentiert werden | MITTELEUROPAN ALALLA https://www.linkedin.com/posts/chantalattia_ces-vaccins-sont-une-exp%C3%A9rimentation-d%C3%A9lai-activity-6784593281922695168-u10g
Jos tiedät muita artikkelin loppuosia, ilmoita minulle, että voin myös jakaa. Ota yhteyttä saadaksesi lisätietoja virallisten julkisten tietojen tulkinnasta.
Lähde:
https://kapitaali.com/neljan-covid-rokotteen-euroopassa-julkisesti-saatavilla-olevan-datan-tarkastelua-30-3-2021/
0 notes