La nature réserve de belles pépites à ceux qui prennent la peine de les découvrir.
Don't wanna be here? Send us removal request.
Text
Le savon
Le savon est formé par l’action d’une base forte sur un corps gras (réaction de saponification). La base forte est l’hydroxyde de sodium dans le cas du savon ordinaire et hydroxyde de potassium dans le cas du savon noir. Le savon est donc un sel composé d’un anion carboxylate et d’un cation Na+ ou K+.

En solution dans l’eau, le savon subit une hydrolyse partielle qui libère des ions carboxylates et du glycérol. L’ion carboxylate a des propriétés tensioactives et détergentes (dissolution des matières non solubles dans l’eau).
Quelques définitions
Un corps gras est composé principalement de triglycérides, des esters de glycérol avec des acides gras. Le glycérol C3H8O3 est le 1,2,3-propanetriol, c'est à dire une chaîne hydrocarbure saturée composée de trois atomes de carbone porteurs chacun d'un groupe hydroxyle.
Un acide gras R-(C=O)OH est un acide carboxylique à chaîne aliphatique. Un chaine aliphatique est un hydrocarbure linéaire ou ramifié ne comportant pas de cycle aromatique.
Un ester est le produit de la réaction d'un alcool sur un acide. La formule d'un ester carboxylique est R-(C=O)O-R'.

Un composé amphiphile
Comme nous l’avons dit plus haut, le savon se dissout partiellement dans l'eau en libérant des ions carboxylates :

L’ion carboxylate possède une extrémité chargée négativement. Cette extrémité est donc hydrophile du fait du caractère polaire de l'eau. Par contre, la chaîne carbonée est apolaire. Elle est donc hydrophobe et lipophile.
Effet tensioactif
Les liquides polaires ne sont pas miscibles aux liquides apolaires. Les molécules/ions polaires s'attirent entre elles de même que les molécules apolaires. Par contre, molécules/ions polaires et apolaires n’ont aucune affinité entre elles. Il n'y a donc pas de mélange possible. Au repos les deux liquides se séparent sous l'effet de la pesanteur. Si on les brasse énergiquement, l'un d’eux (l'huile par exemple) forme des gouttelettes en suspension dans l'autre (l'eau). On appelle cet état une émulsion. La taille des gouttelettes est déterminée par l'intensité des forces de cohésion des molécules entre elles, forces de cohésion qui créent une tension superficielle à l'interface avec l'autre liquide.
Un composé chimique est dit tensioactif s'il intervient sur la tension superficielle entre ces liquides. C'est le cas de l'ion carboxylate. Il se fixe aux molécules apolaires d'un liquide gras par son extrémité lipophile et aux molécules d'eau par sa tête hydrophile. De la sorte, il assure l'interface entre les deux liquides, ce qui entraine la formation de toutes petites gouttelettes d’huile même en l'absence de brassage (solubilisation). Ces gouttelettes ne s'agrègent pas : elles se repoussent du fait de la charge électrique de la tête hydrophile.
C'est le même effet qui conduit à la formation des bulles de savon. Cette fois, c'est l'air qui joue le rôle de fluide apolaire. Il ne se forme pas des gouttelettes mais un film d'eau prisonnier entre deux pellicules de savon.
Effet détergent
Le caractère amphiphile du savon mélangé à l'eau lui permet de jouer le rôle de détergent, en particulier pour éliminer la graisse sur une surface hydrophobe. La longue extrémité lipophile de l'ion n'a pas de difficulté pour s'insinuer entre les particules de graisse et le support (effet détachant). Les ions carboxylates enveloppent ensuite le corps gras, leur queue lipophile adhérant à celui-ci. L'ensemble forme une micelle sphéroïde (têtes hydrophiles dirigées l'extérieur) qui est entraînée dans le flux de l'eau lors du rinçage du fait de son adhérence aux molécules d'eau.
Propriétés désinfectantes
Il en va de même pour son action sur les virus et les bactéries. La partie hydrophobe des ions carboxylates s’accroche à la membrane lipidique du virus ou de la bactérie, alors que sa partie hydrophile est solvatée. De ce fait, la tension superficielle de la membrane est réduite et elle se déchire, entraînée par le mouvement des molécules d'eau. Dans la cas d'un virus, la molécule d’ARN est mise à nu. Le virus devient donc inactif : son accrochage aux cellules vivantes est dépendant de la présence de "protéines Spike" sur la surface de sa membrane. Par ailleurs, son ARN possède des groupements hydrophobes ayant une forte affinité avec la partie lipophile des ions carboxylates. Ceux-ci découpent l’ARN tout comme ils ont décomposé la membrane. Le virus haché menu va former des micelles solubles dans l’eau qui seront entrainées au rinçage.
Remarque 1 : la membrane lipidique des virus ne constitue pas une coque infranchissable. Elle est au contraire fluide. Les molécules qui la constituent (lipides, phospholipides, protéines) se déplacent latéralement à sa surface.
Remarque 2 : les solutions alcooliques (gel hydroalcoolique) dégradent aussi les virus mais leur effet est grandement inhibée sur une surface grasse dans la mesure où l'alcool réagit avec les graisses présentes sur ladite surface (estérification).
Pour en savoir plus :
post sur l’acide carboxylique
post sur les acides gras
post sur les esters
post sur la tension superficielle
glossaire de chimie organique
index
#savon#tensioactif#virus#lipide#amphiphile#hydrophile#hydrophobe#lipophile#acide gras#micelle#émulsion#carboxylate#estérification#ester#glycérol#triglycéride
3 notes
·
View notes
Text
Nombres quantiques et termes spectroscopiques
Rappel sur les nombres quantiques
Les niveaux d’énergie d’un atome sont liés à ceux des électrons de son nuage électronique. Ces états sont quantifiés. Ils sont décrits par 4 nombres quantique :
Le nombre quantique principal n est un nombre entier strictement positif. On dit des électrons qui ont le même nombre quantique principal n qu’ils appartiennent à une même couche. En première approximation, le nombre n est associé à un niveau d’énergie. Nous verrons plus loin que les niveaux d’énergie des différentes couches se chevauchent (voir plus bas le paragraphe sur la règle de Klechkowski).
Le nombre quantique azimutal l est un nombre entier positif ou nul qui est au maximum égal à n-1. On dit des électrons qui ont le même nombre quantique principal n et le même nombre quantique azimutal l qu’ils appartiennent à une même sous-couche. Le nombre quantique azimutal l caractérise le moment cinétique (on parle aussi de moment angulaire) orbital le de l’électron :

Le nombre quantique magnétique ml est un nombre entier compris entre -l et +l. Il correspond aux valeurs que peut prendre la projection du moment cinétique orbital le sur un axe quelconque. A chaque nombre ml correspond une orbitale électronique.Une même orbitale électronique peut accueillir au maximum deux électrons de nombre quantique de spin s différent (principe d’exclusion de Pauli). Le nombre quantique de spin ne peut en effet prendre que deux valeurs : -1/2 ou 1/2. Ce nombre de spin détermine le moment cinétique intrinsèque de l’électron :

Remarque 1
Par convention, on identifie les différentes sous-couches par des lettres : s pour l=0, p pour l=1, d pour l=2 et f pour l=3. Pour distinguer les sous-couches de niveaux différents, on accole à cette lettre un chiffre représentant le nombre quantique principal. Par exemple, la sous-couche (n=3, l=1) est identifiée par l’index 3p.
Remarque 2
Les unités du système international sont mal adaptées au monde microscopique régi par la mécanique quantique. Les physiciens utilisent d’autres unités suggérées pas Niels Bohr au cours des premières décennies du XXème siècle. Très logiquement, l’unité choisie pour le moment cinétique a pour valeur h_barre = h/2pi, ce qui permet de s’affranchir de ce terme dans les formules. Avec une telle unité, les valeurs de moment cinétique se résument à des nombres entiers ou demi-entiers. Rappelons que la valeur de h (constante de Planck) est de 6,626 10-34 J.s.
Moment cinétique atomique
Dans le référentiel d’un atome, il est possible de définir le moment cinétique de l’ensemble de ses électrons :

Ce moment cinétique est une grandeur quantique tout comme le moment des électrons pris individuellement. On montre que :
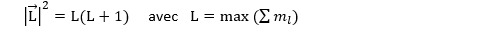
La projection du moment cinétique atomique sur un axe quelconque est la somme des nombres quantiques magnétiques de chacun des électrons :

Même chose pour le moment cinétique intrinsèque des électrons :
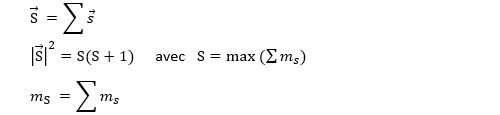
On remarquera que les vecteurs L et S ne sont pas nécessairement orientés dans la même direction.
Niveaux d’énergie et règle de Klechkowski
Les électrons d’un atome se répartissent sur les différentes couches et sous-couches de façon à minimiser leur niveau d’énergie tout en respectant le principe d’exclusion de Pauli. La règle de Klechkowski permet de déterminer l’ordre de remplissage des différentes sous-couches. Elle fait l’hypothèse d’une dégénérescence des niveaux d’énergie au sein d’une même sous-couche (plusieurs états ayant la même énergie) et stipule que le niveau d’énergie des sous-couches croît avec la somme n+l. Lorsque deux sous-couches sont caractérisées par une même somme n+l, on les classe par ordre croissant de n. Ainsi, la sous-couche 3p (3,1) est classée avant la sous-couche 4s (4,0). De même la couche 3d (3,2) est classée avant la couche 4p (4,1) qui devance la couche 5s (5,0).

Comme on le voit dans le tableau qui précède, les différentes rangées du tableau de classification périodique des éléments sont caractérisées par des sous-couches n’ayant pas nécessairement le même nombre quantique principal. L’analyse des propriétés chimiques des éléments d’une même rangée conforte cependant la pertinence de ce tableau de classification. En fait, chaque rangée ouvre une nouvelle séquence en matière de propriétés chimiques. Tout se passe comme si, pour un atome de la nième rangée, les électrons des sous-couches des n-1 rangées précédentes ne jouaient plus aucun rôle. Seuls interviennent, dans la capacité à nouer des liaisons et la réactivité des éléments, les électrons occupant les orbitales des sous-couches attribuées à la nième rangée.

On appelle bande de valence l’ensemble des sous-couches caractérisant cette rangée. L’hypothèse hydrogénoïde consiste à considérer que le noyau et les couches inférieures forment une sorte de noyau virtuel autour duquel orbitent les électrons de la bande de valence. Elle est très utilisée en chimie quantique. On représente ce noyau virtuel en mettant entre crochet le gaz noble qui conclut la rangée immédiatement inférieure. Ainsi par exemple pour le carbone : [He] 2s2, 2p2.
Moment magnétique
Pour déterminer le moment magnétique d’un électron en orbite autour du noyau d’un atome, on peut s’appuyer sur les équations de la mécanique classique. C’est parfaitement faux mais il se trouve qu’on parvient à un résultat juste :

le étant le moment cinétique de l’électron et mul le moment magnétique induit. A l’échelle de l’atome, il vient :

Le moment cinétique intrinsèque des électrons contribue au moment magnétique total d’un atome. On peut écrire de la même façon :

Remarque :
Tout comme dans le cas du moment cinétique, les physiciens n’utilisent pas les unités du système international pour exprimer le moment magnétique en mécanique quantique. Ils préfèrent utiliser une unité appelée magnéton de Bohr et qui correspond au facteur muB des équations précédentes :

Couplage spin-orbite
Si l’on reprend le modèle orbital que nous avons évoqué ci-dessus, le mouvement des électrons dans le champ magnétique induit un couplage entre ML et MS, couplage appelé couplage spin/orbite, ou couplage de Russel-Saunders. L’énergie associée à ce couplage est :

L’opérateur quantique correspondant au produit des vecteurs L et S ne commute pas avec le hamiltonien représentatif de l’énergie de l’atome. Il n’est donc pas possible de représenter l’état énergétique d’un atome par les seuls nombres quantiques L et S. Pour résoudre cette difficulté, il faut introduire un nouvel opérateur, J, qui correspond au moment cinétique total de l’atome :

J2 commute avec le hamiltonien tout comme L2 et S2. En réécrivant le produit L.S sous la forme suivante :

on peut trouver une base de vecteurs propres du hamiltonien permettant de décrire les différents états d’énergie d’un atome. Ceci se fait au prix de l’introduction d’un troisième nombre quantique : le nombre J. lorsque L > S, J peut prendre 2S+1 valeurs différentes (souvenons-nous que L et S ne sont pas nécessairement colinéaires) :
L-S < L-S+1 < ... < L+S-1 < L+S
La figure suivante illustre les différents nombres J associés à un même couple (L, S) dans le cas où S =1/2 et où S =1.

Lorsque S > L (ce qui est plus rare), ce n’est pas S que l’on projette sur L mais l’inverse. Il y a dans ce cas 2L+1 valeurs de J comprises entre S-L et S+L. On résume ceci en une seule formule en écrivant que :

On appelle multiplicité de spin l’expression 2S+1. Suivant la valeur de cette multiplicité, on parle de singulet, de doublet, de triplet ou de multiplet.
Terme spectroscopique
On appelle terme spectroscopique principal le symbole composé de la manière suivante :
2S+1L
L étant une lettre majuscule, appartenant à la suite S, P, D, F, G, H, I, K..., représentative du moment cinétique de l’atome. On reconnait dans les quatre premières les lettres retenues pour identifier les sous-couches électroniques. On appelle terme spectroscopique complet le symbole composé de la manière suivante :
2S+1LJ
Cette notation est très utilisée en spectroscopie atomique.
Règle de Hund
Revenons au couplage spin-orbite. Nous avons vu qu’il pouvait s’exprimer en fonction du produit L.S. Or :
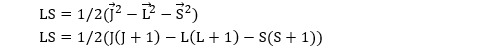
Contrairement à l’hypothèse émise pour établir la règle de Klechkowski, on voit que le couplage spin-orbite introduit une différenciation entre les niveaux d’énergie des électrons au sein d’une même sous-couche. Cette différenciation ne ruine pas complètement cette règle : les écarts d’énergie sont faibles. On parle à ce sujet de structure fine. La formule qui précède permet de prédire l’échelonnement des différents « micro-états » correspondant à différents termes spectroscopiques. La règle de Hund permettent de prédire le remplissage au sein d’une même sous-couche pour minimiser l’énergie totale. Elle stipule que le remplissage doit maximiser la valeur de S, donc minimiser le nombre de doublets électroniques (orbitales accueillant deux électrons de spin opposé). Elle permet également d’écrire le terme spectroscopique associé à l’état fondamental :
lorsque la sous-couche est remplie à moins de la moitié J = |L-S|,
lorsque la sous-couche est remplie J = S,
lorsque la sous-couche est remplie à plus de la moitié J = L+S.
Remarque : les sous-couches remplies n’interviennent pas dans le moment cinétique total ni dans le moment magnétique puisque les termes L et S de ces sous-couches sont nuls.
Exemples
Appliquons ce qui précède aux atomes de la première rangée du tableau de classification périodique.

Le niveau fondamental d’énergie de l’hydrogène est donc caractérisé par le terme spectroscopique 2S1/2. Il y a théoriquement deux états possibles puisque le spin peut être égal à +1/2 ou – 1/2. Le moment orbital étant nul il n’y a par contre pas de couplage entre moment intrinsèque et moment orbital. Le niveau fondamental de l’hélium est 1S0. Il n’y a cette fois qu’un état possible. Il est dit singulet. Même logique pour le lithium L et le béryllium Be.

Les éléments de la première colonne du tableau de classification périodique des éléments (métaux alcalins) ont le même terme spectroscopique que le lithium. Même chose pour les éléments de la deuxième colonne (métaux alcalino-terreux) par rapport au béryllium. Prenons maintenant des exemples dans le bloc p de la deuxième rangée. Les valeurs de ml pour chacune des trois orbitales sont respectivement 1, 0, -1.
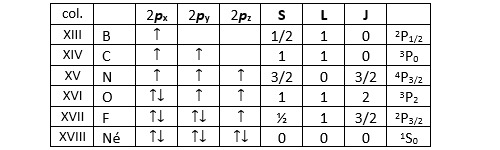
Comme dans le cas du lithium et du béryllium, Les valeurs de S, L et J de chacun de ces éléments sont les mêmes pour tous les éléments de leur colonne. Dans le cas du bloc d (colonnes 3 à 12, métaux de transition) la situation ne suit pas une logique aussi limpide. Prenons tout d’abord l’exemple du vanadium V ([Ar] 4s2, 3d3). Les valeurs successives de ml des orbitales de la sous-couche d sont 2, 1, 0, -1, -2.

Son état fondamental est donc très logiquement 4F3/2. Idem pour le nickel Ni ([Ar] 4s2, 3d8) :

L’état fondamental du nickel est 3F4. C’est un état triplet. Toujours dans la même logique, l’état fondamental des éléments dont la sous-couche d est remplie (le zinc Zn, le cadmium Cd et le mercure Hg) est le même que celui des gaz nobles, c’est-à-dire 1S0. (C’est une des raisons pour lesquelles leurs propriétés physico-chimiques sont différentes de celles des autres éléments du bloc d.)
Intéressons-nous maintenant au chrome Cr. La configuration de sa bande de valence est ([Ar] 4s1, 3d5). Le niveau d’énergie de sa sous-couche 3d est très proche de celui de la sous-couche 4d et tout se passe comme si elles faisaient une seule et même sous-couche. Il vient :

Dans le calcul de L, le premier zéro correspond au moment orbital de l’orbitale 4s. L’état fondamental du chrome est donc 7S3. Le cuivre Cu, le niobium Nb, le molybdène Mo, l’argent Ag, le platine Pt et l’or Au ont également une sous-couche 4s incomplètement remplie. Prenons le cas du cuivre ([Ar] 4s1, 3d10) :

Son état fondamental est 1S1/2. La configuration du palladium Pd est encore plus bizarre : [Kr] 5s0, 4d10.
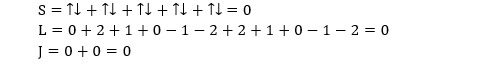
Son état fondamental est 1S0, comme les alcalino-terreux ou les gaz nobles !
Ordre de grandeur
Une formule simple donne l’ordre de grandeur du couplage spin orbite :

Z étant le numéro atomique de l’atome considéré.
Micro-états
Nous nous sommes intéressés jusqu’à présent à l’état fondamental des atomes. A l’échelle quantique, les électrons sont turbulents et ne se résignent pas à occuper un seul état, fût-il de plus basse énergie. (Ce serait d’ailleurs contraire au principe d’incertitude d’Heisenberg.) La seule agitation thermique l’incite à en visiter d’autres, surtout s’ils ont une énergie très voisine. Disons plutôt, pour être plus rigoureux, qu’il se trouve dans une superposition d’états avec un remplissage différent de la sous-couche de plus haute énergie. Revenons à l’exemple du carbone C = [He] 2s2, 2p2. Nous allons détailler tous les configurations possibles (on parle de micro-états) pour les électrons de sa bande de valence. Il y a 3 orbitales p avec chacune deux orientations de spin possibles, ce qui fait 6 choix possibles pour le premier électron. Une fois le premier électron casé, il ne reste que 5 options pour le second (principe d’exclusion de Pauli). Ceci donne théoriquement 30 possibilités, mais il faut tenir compte du fait que les deux électrons sont indiscernables : il n’y en a donc en réalité que 15.

Commençons par le couple (mL, mS) qui présente la valeur de mL la plus grande. Il apparaît ici dans la première colonne. C’est un état 1D (L=2, S=0). Mais n’oublions pas que mL est la projection de L sur un axe quelconque. Il peut donc aussi prendre les valeurs 1, 0, -1 et -2. Les micro-états (2,0), (1,0) (0,0), (-1,0) et (-2,0) sont donc des variantes possibles de cet état 1D. Nous les notons en rouge dans le tableau.
Poursuivons avec le couple (mL, mS) qui présente, parmi les couples non encore assignés, la valeur mL la plus grande et la valeur de mS la plus grande. C’est le couple (L=1, S=1). Même raisonnement que ci-dessus. C’est un état 3P et cet état 3P peut être décliné de diverses autres façons puisque mL peut prendre les valeurs -1, 0 et +1 et que mS peut prendre les valeurs -1 et +1. Nous les notons en vert. Le seul couple non assigné est le couple (0, 0). C’est un état 1S et nous le notons en bleu.

On voit donc que le carbone [He] 2s2, 2p2 peut se présenter sous 3 configurations différentes : 1S, 3P, 1D. Parmi celles-ci, les configurations 3P et 1D sont des multiplets. L’état 3P0 qui possède l’énergie la plus basse appartient à la configuration 3P.
Remarque : certains micro-états peuvent être indifféremment attribués à 3P ou à 1D. Il n’y a aucun mystère derrière cela : deux vecteurs différents peuvent avoir la même projection sur un axe.
La recherche et l’identification des micro-états fait l’objet d’un développement détaillé dans un autre post.
Saut quantique et états excités d’un atome
Lorsqu’un atome est excité, un électron de la bande de valence saute dans un état d’énergie supérieure. Lorsque l’électron revient à un niveau d’énergie plus faible il émet un photon dont la fréquence est déterminée par l’écart d’énergie entre ces deux niveaux :

Les seuls états d’énergie qu’il peut occuper sont ceux prédits par la mécanique quantique. Les règles de sélection de Russel-Saunders expriment ces restrictions à l’échelle d’un atome. Elles sont basées sur les lois de conservation du moment cinétique et du spin :

(La restriction sur Delta_S provient du fait que la fonction d’onde de spin est antisymétrique, contrairement à celle du moment cinétique.) La figure qui suit illustre les sauts possibles entre les états d’énergie des couches 2 à 6 de l’atome de lithium. (Le lithium ne possède qu’un électron dans sa bande de valence. De ce fait L=l et S=s.) Le trait rouge correspond au saut entre l’état fondamental et le niveau d’énergie directement supérieure (raie principale).
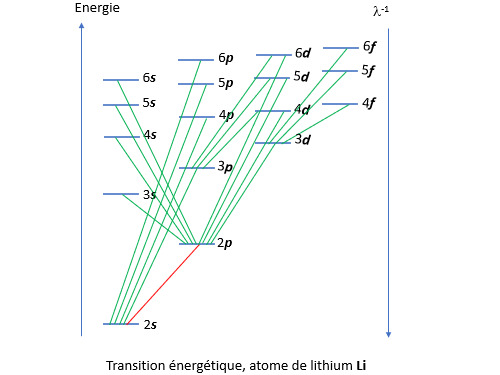
L’atome peut être excité de diverses façons. Lorsqu’un solide est porté à haute température par exemple, il émet une lumière qui peut aller du rouge au blanc (d’où l’expression chauffé à blanc). Ce phénomène porte le nom d’incandescence. Dans les lampes à vapeur de sodium qui éclairent les échangeurs d’autoroute, l’excitation des atomes de sodium est réalisée par des décharges électriques (luminescence). La configuration de l’état fondamental du sodium Na est [Ne] 3s1. Le champ électrique excite l’unique électron de valence qui passe en 3p1. Il revient à l’état fondamental en émettant un photon à 589 nm (couleur orangée). Les électrons de valence ne sont pas les seuls à pouvoir être excités. Il est possible d’exciter des électrons des couches inférieures en les bombardant avec des rayons X. Si on reprend l’exemple du sodium par exemple, on peut le mettre dans l’état 1s2, 2s2, 2p5, 3s2 de cette façon.
Moment magnétique d’un atome
Un dernier mot au sujet du moment magnétique. Nous avons jusqu’à présent considéré ses deux composantes ML et MS séparément. Elles se combinent pour donner un moment magnétique total M :

Il résulte de ces deux équations que le moment magnétique total d’un atome n’est nécessairement pas aligné avec son moment cinétique total J. On peut toutefois rétablir le lien entre J et M en faisant intervenir un terme appelé facteur de Landé :

avec :

Nous verrons dans un post ultérieur l’impact ce facteur sur le rayonnement des atomes.
Pour en savoir plus :
post sur la classification périodique des éléments
post sur l’équation de Schrödinger
post sur le nuage électronique
post sur les micro-états
post sur l’effet Zeeman et l’expérience de Stern et Gerlach
post sur le spectre d’émission de l’hydrogène
post sur la raie à 21 cm de l’hydrogène
post sur le luminescence
post sur les métaux de transition
post sur les métaux alcalins et alcalino-terreux
index
#chimie#quantique#nombre quantique#zeeman#spin-orbite#landé#dégénérescence#moment cinétique#moment magnétique#classification périodique#hund#klechkowski#spin#orbitale#gerlach#stern#spectroscopie#terme spectroscopique#micro-état#saut quantique
2 notes
·
View notes
Text
Termes spectroscopiques et micro-états
Nous nous sommes jusqu’à présent intéressé à l’état de plus basse énergie des atomes. Dans le cas du titane par exemple ([Ar] 4s2, 3d2) le terme spectroscopique de cet état de plus basse énergie est 3F2. La règle de Hund nous a aidé à déterminer ce terme spectroscopique :

Dans le monde incertain et changeant de la physique quantique, les électrons, pour peu qu’ils aient un peu d’énergie à revendre (thermique, électrique...) mais pas suffisamment pour sauter dans une sous-couche d’énergie supérieure, ne vont pas rester sagement dans les cases que nous leur avons assignées. Ils vont au contraire occuper tous les micro-états possibles de la sous-couche 3d2 compatibles avec le principe d’exclusion de Pauli.
Considérons le premier électron. Nous l’avons casé dans l’orbitale de nombre quantique ml = 2 mais il peut aussi bien occuper chacune des 4 autres orbitales de la sous-couche d et avoir le spin -1/2 ou +1/2, ce qui fait 10 possibilités. Supposons qu’il ait fixé son choix, il reste au second 9 choix possibles (le principe d’exclusion de Pauli empêche qu’il se trouve dans le même état que le premier). Cela nous fait 90 combinaisons en tout. Mais la distinction que nous avons faite entre 1er électron et 2ème électron est formelle : ils sont indiscernables. Il n’y a donc en fait que 45 micro-états différents possibles. Nous allons les lister.
Dénombrement des micro-états
Nous sommes dans une sous-couche d et il y a deux électrons, la projection du moment cinétique orbital L de l’atome sur l’axe de mesure peut donc prendre toutes les valeurs de -4 à +4 tandis que son spin peut prendre les valeurs -1, 0 et 1.

Remarque : mL et mS sont les valeurs que peuvent prendre les projections de L et S sur l’axe de mesure.
Les deux tableaux qui suivent détaillent toutes les configurations possibles respectant le principe d’exclusion de Pauli. Dans le premier sont répertoriées toutes les combinaisons avec mS = 1. Celles pour lesquelles mS = -1 donnent un tableau qui est l’exact symétrique de celui-ci.

Remarque : la première rangée ainsi que la dernière sont vides en raison du principe d’exclusion de Pauli.
Dans le deuxième tableau sont répertoriées toutes les configurations pour lesquelles mS est nul.
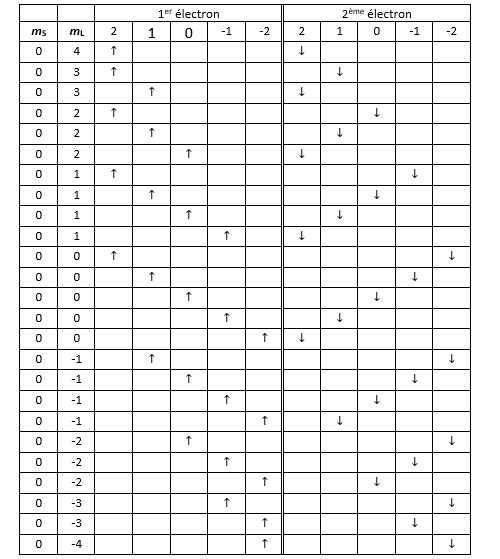
L’étape suivante consiste à faire la synthèse du nombre de micro-états pour chacun des couples (mL, mS). On retrouve bien les 45 micro-états prédits initialement.
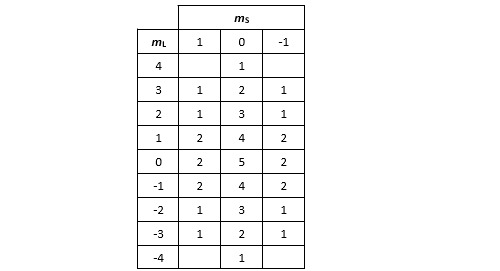
Nous allons rechercher maintenant les termes spectroscopiques principaux correspondant à ces différents micro-états. Considérons dans un premier temps les combinaisons présentant le terme mL le plus élevé. Ici il n’y en a qu’une et elle correspond au couple (mL=4, mS=0). Elle est caractéristique du terme spectroscopique 1G. Prenons maintenant un peu de recul. Si le titane possède un état tel que (L=4,S=0), il n’y a aucune raison que le moment cinétique orbital de cet état soit orienté uniquement dans l’axe choisi pour faire la mesure. Le terme spectroscopique 1G se décline donc également avec des valeurs de mL égales à 3, 2, 1, 0, -1, -2, -3, -4, ce qui nous fait 9 micro-états en tout. Puisque nous les avons identifier, nous pouvons les retirer du tableau. Pour cela, il suffit d’enlever 1 à tous les éléments de la colonne mS = 0.
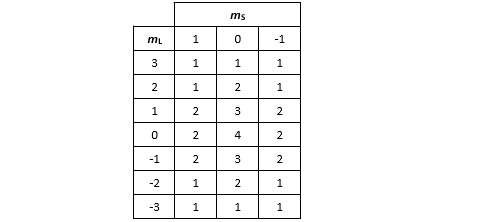
Poursuivons. Même démarche : recherchons les combinaisons présentant le terme mL le plus élevé. Cette fois il y en a trois : (3, 1), (3, 0) et (3, -1). On reconnait un état triplet dont le terme spectroscopique est 3F. Si on applique le même raisonnement que ci-dessus, il est clair qu’un état (L=3, S=1) peut apparaître sous la forme de plusieurs micro-états avec mL prenant toutes les valeurs entières possibles entre -3 et +3 et mS toutes les valeurs entières entre -1 et +1. Ceci nous fait 21 micro-états en tout. Pour les retirer du tableau il faut enlever 1 à toutes les cases.
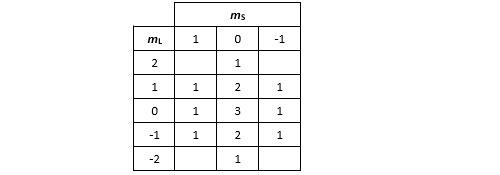
Si on poursuit la même démarche, on trouve le couple (2, 0) qui correspond au terme spectroscopique 1D, lequel regroupe avec 5 micro-états.

On aura compris le principe de ce dénombrement. Il nous donne également le terme spectroscopique 3P avec 9 micro-états et le terme spectroscopique 1S qui est singulet. On a donc au total 9 micro-états 1G, 21 micro-états 3F, 5 micro-états 1D, 9 micro-états 3P et un micro-état 1S. On constatera au passage que le micro-état (1, 0) par exemple peut très bien relever des états associée aux termes spectraux 1G, 3F, 1D ou 3P. Rien d’anormal dans tout cela. Cela signifie tout simplement que dans la « vraie vie », la fonction d’onde d’un atome dans ce micro-état est dans une superposition de ces 4 états !
Termes spectraux secondaires
Nous avons listé les termes spectraux principaux mais, pour être exhaustifs, il nous faudrait leur formulation complète : 2S+1LJ. Nous verrons dans un post ultérieur qu’elle joue un rôle essentiel dans certains phénomènes physiques comme l’effet Zeeman. Prenons par exemple le terme 3P. La valeur maximale de J pour cet état est J = L+S = 2. Le terme spectroscopique complet qui lui est associé est donc 3P2. Le nombre de micro-états auquel on peut attribuer ce terme spectroscopique est égal à 2J+1 = 5. Dans le cas du terme 3F, la valeur maximale de J est 4. Le terme spectroscopique complet qui lui est associé est donc 3F4 et il regroupe 9 micro-états.

Aïe... Cela ne nous fait en tout que 29 états. Il en manque donc 16. Si l’on se reporte aux décomptes faits plus haut, on voit d’ailleurs qu’on n’a pour le moment comptabilisé que 9 micro-états de type 3F alors qu’on en avait décompté 21 ! Idem pour 3P : on n’en a comptabilisé que 5 alors qu’on en attendait 9. Ceci résulte du fait que l’on n’a tenu compte que des micro-états tels que J = L+S. Or, rien n’oblique L et S à être orienté dans la même direction. Pour retrouver les micro-états manquants, il faut tenir compte aussi de ceux pour lesquels |L-S| < J < L+S.
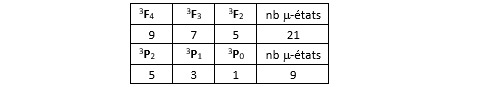
Nous voilà rassurés : nous avons bien retrouvé nos 45 micro-états.
Energies associées aux termes spectroscopiques
Reste à déterminer l’échelle des énergies des micro-états associés à ces différents termes spectroscopiques. Les règles de Hund vont nous aider :
les termes spectroscopiques de plus grande multiplicité ont l’énergie la plus basse,
parmi ceux-ci, ceux qui ont le moment L le plus élevé ont l’énergie la plus basse,
enfin, pour un même couple (L,S), lorsque la sous-couche est moins qu’à moitié remplie, l’énergie décroît avec J alors que c’est le contraire lorsque la sous-couche est plus qu’à moitié remplie.
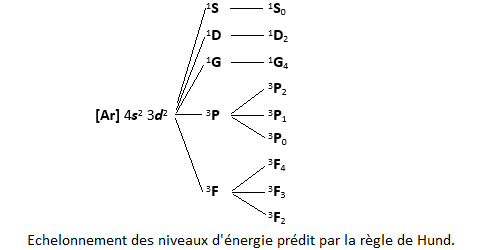
La réalité n’est pas toujours exactement conforme à la règle de Hund. L’écart entre les niveaux d’énergie est d’ailleurs souvent très faible, d’où des chevauchements. Seul le terme spectroscopique de l’état fondamental peut être prédit avec certitude. Ici, c’est 3F2.
Ordre de grandeur
Nous avons vu que l’ordre de grandeur du couplage spin orbite était donné par une formule simple :

Z étant le numéro atomique de l’atome considéré. Dans le cas du titane, Z = 22 et n = 3. L’écart d’énergie entre le micro-état 3P0 et le micro-état 3F2 est de 0,138 eV. Soit lambda la longueur d’onde correspondant à un tel écart :

Dans le cas considéré, elle vaut 9 microns, ce qui la situe dans l’infra-rouge.
Atome de Nickel
Le travail que nous avons fait est plutôt fastidieux... et il n’y a que 2 électrons dans la sous-couche 3d ! Que dire du nickel Ni qui en compte 8... Pas de panique. On va utiliser une astuce fort utile. Au lieu de comptabiliser les électrons on va s’intéresser aux « trous ». Pour être plus clair, au lieu de placer les électrons dans des cases vides, on va en retirer de cases pleines. Retirer un électron de spin +1/2 revient à ajouter un trou de spin -1/2. Retirer un électron de spin -1/2 revient à ajouter un trou de spin +1/2. Comme le moment cinétique L et le spin S d’une sous-couche pleine sont tous les deux nuls, on voit que le décompte dans le cas où on a deux trous conduit au même résultat que dans le cas où l’on a deux électrons... A une différence près : cette fois la sous-couche est plus qu’à moitié remplie. Le terme spectroscopique de l’état fondamental du nickel n’est pas 3F2 mais 3F4.
Termes spectroscopiques d’un état excité
L’exemple du titane partait de l’hypothèse que ses électrons de valence restaient dans la sous-couche 3d. Qu’ne est-il lorsqu’il est excité et que l’un de ses électrons saute dans une sous-couche d’énergie plus élevée ?
Prenons le cas du calcium [Ar] 4s2. Le terme spectroscopique de l’état fondamental est 1S0 (sous-couche 4s remplie). Dans le premier état excité l’un des électrons de valence passe dans la sous-couche 4p. L’électron 4s1 peut se trouver dans l’état (0,-1/2) et dans l’état (0,1/2). Pour l’électron 4p1 il y a plusieurs combinaisons puisque ml peut prendre les valeurs 1, 0, -1 et s les valeurs -1/2 et +1/2.

D’où l’on tire le dénombrement suivant :
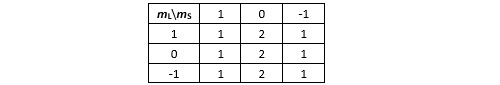
Il est facile de voir que les termes spectroscopiques principaux sont 1P et 3P. Pour ce qui est des termes complets, le premier ne peut s’écrire que d’une seule façon : 1P1 et il couvre 3 micro-états. Quant au deuxième, la configuration 3P2 n’épuise pas tous les micro-états possibles (5 micro-états) et il faut lui adjoindre les configurations 3P1 (3 micro-états) et 3P0.
Quelles sont les transitions possibles ? Les transitions dL=1, dJ=1 mais pas les deux autres (une transition J=0 vers J=0 n’est pas possible même si dL=1).
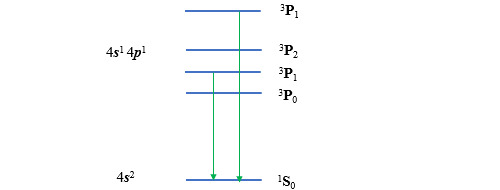
Revenons à l’atome de nickel. Le premier état excité de cet atome est l’état 4s1 3d9. Le dénombrement des micro-états ne pose aucune difficulté : l’électron de la sous-couche 4s ne peut se trouver que dans les états (0,-1/2) et (0,+1/2). Quant au trou de la sous-couche 3d9, il ne peut être que dans les états (l,-1/2) et (l,+1/2) avec l compris entre -2 et +2. On en déduit le tableau suivant.

On peut en extraire les termes spectroscopiques 3D3 et 1D2. Ces termes ne recouvrent que 12 micro-états sur 20. On vérifie facilement que tous les micro-états 1D ont été dénombrés (il y en a 5) mais pas tous les micro-états 3D (il devrait y en avoir 15). Il faut donc leur adjoindre les termes 3D2, 3D1.
Si on s’intéresse aux niveaux d’énergie de ces états excités par rapport aux niveaux associés à la configuration dite non excitée (4s2 3d8), on pourrait s’attendre à ce que les termes 3D aient un niveau supérieur à celui des niveaux 3F et inférieur à celui des niveaux 3P. En fait, il y a un entrelacement entre les niveaux 3F et les niveaux 3D.
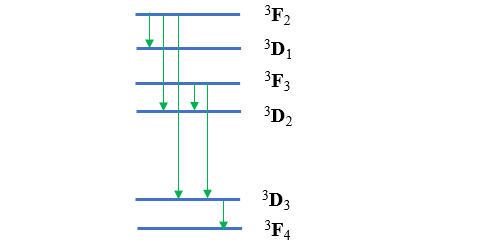
Les seules transitions possibles sont celles qui respectent les règles édictées plus haut :
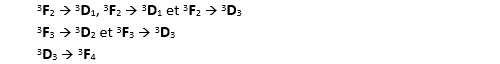
Les fréquences correspondant à ces sauts sont dans le domaine de l’infra-rouge.
Pour en savoir plus :
post sur la classification périodique des éléments
post sur le nuage électronique
post sur les nombres quantiques et les termes spectroscopiques
post sur l’effet Zeeman et l’expérience de Stern et Gerlach
post sur le spectre d’émission de l’hydrogène
post sur la raie à 21 cm de l’hydrogène
post sur les métaux de transition
post sur les métaux alcalins et alcalino-terreux
index
#nombre quantique#saut quantique#landé#spectroscopie#micro-état#émission#terme spectroscopique#électron#spin#spin-orbite
3 notes
·
View notes
Text
Spectre de l’hydrogène
La longueur d’onde des raies émises par l’atome d’hydrogène est prédite par une formule appelée formule de Rydberg :

Cette formule généralise une formule empirique établie par Johann Balmer en 18885 à partir des raies de l’hydrogène dans le domaine visible. Le fondement théorique de cette formule ne fut découvert que plus tard, grâce aux travaux de Niels Bohr. Il démontra que les raies spectrales d’un atome correspondaient à des sauts quantiques entre les différents états d’énergie possible de ses électrons. Ces états d’énergie sont quantifiés et l’équation de Schrödinger permet de les déterminer. Chacun de ces sauts se traduit par l’émission d’un photon dont la longueur d’onde est inversement proportionnelle au différentiel d’énergie :

Dans le cas d’un atome d’hydrogène, on peut simplifier l’équation de Schrödinger en l’appliquant à un électron évoluant dans un potentiel coulombien. Il est possible alors possible de la résoudre analytiquement. On montre que l’écart entre les différents niveaux d’énergie possibles correspondent bien aux valeurs prédites par la formule de Rydberg. En astronomie, on a donné un nom aux différentes séries de raies spectrales de l’atome d’hydrogène :


La formule de Rydberg s’applique aussi aux atomes hydrogénoïdes. Les atomes hydrogénoïdes sont des cations dépouillés de tous leurs électrons sauf 1 (Li2+, Be3+...). Dans ce cas :

Z étant le numéro atomique de l’atome considéré, M sa masse atomique et me la masse de l’électron.
Lorsque les atomes possèdent plus d’un électron dans leur bande de valence, la formule de Rydberg ne s’applique plus. Il faut tenir compte d’un phénomène appelé couplage spin-orbite (voir le post à ce sujet).
Pour en savoir plus :
post sur la classification périodique des éléments
post sur le nuage électronique
post sur les nombres quantiques et les termes spectroscopiques
post sur l’effet Zeeman et l’expérience de Stern et Gerlach
post sur la raie à 21 cm de l’hydrogène
index
0 notes
Text
Composés aromatiques
En chimie organique, les composés aromatiques sont des molécules cycliques au sein desquelles les atomes qui composent le cycle partagent des électrons délocalisés. Le benzène C6H6 en est l'exemple le plus connu. Les atomes de carbone du benzène occupent les sommets d'un hexagone et chacun d'entre eux entretient une liaison covalente avec ses deux voisins ainsi qu'une troisième avec un atome d'hydrogène. Ces douze atomes sont dans un même plan. Ce qui fait la spécificité du benzène, c'est que chaque atome de carbone met en plus en commun avec les autres son quatrième électron de valence. Ces électrons occupent une orbitale pi étendue à tout le cycle.
Le chimiste allemand Erich Hückel a établi les règles qui caractérisent le caractère aromatique (l'aromaticité) d'une molécule :
Il faut qu'elle soit cyclique et plane.
Il faut que tous les atomes du cycle aient une orbitale p perpendiculaire au plan de la molécule.
Il faut que ces orbitales se recouvrent pour former une orbitale commune.
Il faut que le nombre d'électrons occupant cette orbitale commune soit égal à 4xn + 2, n pouvant être égal à 1, 2, 3, 4...
La mise en commun de cette orbitale conduit à une diminution de l'énergie électronique des électrons, ce qui confère une grande stabilité à la molécule. Le benzène répond à tous ces critères pour une valeur de n égale à 1. Le cyclohexane C6H12 par contre n'y répond pas. Le cyclohexane est dit alicyclique. Sa molécule n'est pas plane.
Monocycles
Le benzène a de nombreux dérivés également aromatiques. On peut citer tout d'abord les alkylbenzènes obtenus par alkylation du benzène, comme le toluène C6H5-CH3 (méthylbenzène) ou le styrène C6H5-CH=CH2 (phényléthylène). Le toluène est le composant de base du trinitrotoluène (TNT), un explosif puissant. Le styrène est le monomère du polystyrène.
Le phénol C6H5OH est un énol aromatique, tout comme la plupart des dérivés phénolés comme l'acide salicylique (composant primaire de l'aspirine), le paracétamol HO-C6H4-NH-C(=O)CH3 ou certaines molécules que l'on trouve dans le cannabis.
Parmi les amines aromatiques monocycliques, on peut citer l'aniline C6H5-NH2 ou la dopamine C8H11NO2. La dopamine est un neurotransmetteur associé à la notion de prise de risque. Elle est constituée d'un cycle benzène porteur de deux groupes -OH (c'est donc un diol) et d'un groupe éthylamine -CH2-CH2NH2 (formule semi-développée (HO)2C6H3-C2H4NH2).
Autres exemples : le nitrobenzène C6H5-NO2 et le chlorobenzène C6H5-Cl qui sont des produits chimiques très utilisés, notamment pour produire des pesticides pour le second.
Hétérocycles
Certains hétérocycles dérivés du benzène présentent également un caractère aromatique. Prenons le cas de la pyridine C5H5N. La pyridine est constituée d'un cycle benzénique dans lequel on aurait substitué un atome d'azote à un atome de carbone. Ce cycle porte un atome d'hydrogène en moins puisque la valence de l'azote est de 3. En plus d'être un composé aromatique, la pyridine est une base de Lewis. L'azote a 5 électrons sur sa couche L dont deux sont engagés dans une liaison covalente avec les atomes de carbone voisins et un participe à la liaison délocalisée. Il lui reste donc un doublet non liant, ce qui confère à la molécule son caractère de base de Lewis. Idem pour la pyrimidine C4H4N2 (deux atomes d'azote dans le cycle). Comme nous le verrons plus loin, la pyrimidine est une base azotée qui joue un rôle central dans la chimie du vivant.
Pyrrole et hétérocycles à 5 atomes
Le benzène est un cycle comportant 6 atomes de carbone. Il n'existe pas de composé aromatique basés sur un cycle à 5 atomes de carbone : la règle de Hückel impose en effet un nombre minimum de 6 électrons délocalisés. Il existe par contre des hétérocycles aromatiques à 5 atomes.

C'est le cas de la molécule de pyrrole C4H4NH (aussi appelée azole) dont le cycle est composé de 4 atomes de carbone et 1 d'azote. Comme on l'a dit plus haut, l'azote compte 5 électrons dans sa bande de valence. Il entretient une liaison covalente avec ses deux voisins carbone et une avec un atome d'hydrogène. Les deux électrons restant participent à la liaison délocalisée, ce qui permet de satisfaire à la règle de Hückel bien que le cycle ne compte que 5 atomes. Par contre, contrairement à la pyridine, le pyrrole n'a pas de doublet non liant puisque tous ses électrons de valence sont engagés dans des liaisons chimiques. Ce n'est donc pas une base de Lewis. La pyrrolidine C4H9N quant à elle n'est pas un composé aromatique. C'est un cyclopentane dans lequel un des groupes -CH2- constituant l'un des sommets du pentagone a été remplacé par un groupe -NH-. La pyrrolidine ne comporte pas de liaison délocalisée.
L'imidazole C3H4N2 est un hétérocycle à trois atomes de carbone et deux d'azote. L'un est porteur d'un atome d'hydrogène, comme dans le pyrrole, l'autre non. Ce deuxième atome d’azote entretient une liaison covalente avec ses deux voisins carbone et confie un troisième électron à la liaison délocalisée. Il lui reste donc un doublet non liant, ce qui fait de l''imidazole une base de Lewis. Il est en fait surtout connu pour ses propriétés de ligand.

Le furane C4H4O est un hétérocycle à 4 atomes de carbone et un d'oxygène. L'oxygène (valence 2) ne porte pas d'atome d'hydrogène. Il entretient une liaison covalente avec ses deux voisins et contribue à la liaison délocalisée avec un de ses doublets électroniques (l'oxygène a 6 électrons dans sa couche de valence). Le furane est donc lui aussi un composé aromatique, tout comme le thiophène C4H4S, pour les mêmes raisons.
Composés polycycliques
Le biphényle C12H10 (phénylbenzène) est le plus simple des composés aromatiques polycycliques. Il résulte de la substitution d'un groupe phényl -C6H5 à l'un des atomes d'hydrogène du benzène. Les composés aromatiques polycycliques comprenant plusieurs groupes phényl sont très nombreux. Ils constituent une grande partie de la classe des hydrocarbures aromatiques polycycliques (HAP), dont beaucoup sont considérés comme écotoxiques. L'un des plus connus du grand public est le bisphénol, très utilisé jusqu'à une date récente et aujourd'hui interdit en raison de ses propriétés de perturbateur endocrinien (formule HO-C6H4-C(CH3)2-C6H4-OH).
Il existe une autre catégories de composés aromatiques polycycliques : ceux dans lesquels les cycles partagent un segment en commun. Le naphtalène C10H8 par exemple (la naphtaline de nos grands-mères) est constitué de deux molécules de benzéne accolées. La liaison délocalisée du naphtalène comporte 10 électrons (n = 2). Dans la molécule de benzopyrène C20H12, ce sont 5 molécules de benzène qui sont accolées (une rangée de 3, une rangée de 2). Seuls les 18 atomes de carbone périphériques du benzopyrène participent à la liaison délocalisée (n = 4).
L'indole C8H6NH est constitué d'un cycle benzénique accolé à un pyrrole (n = 2). L’indole est un composant de l'indigo. Tout comme le pyrrole, ce n'est pas une base de Lewis. La sérotonine C10H12N2O est un dérivé de l'indole (une indolamine). Le cycle benzène de la sérotonine porte un groupe -OH et le cycle pyrrole un éthyloamine -CH2-CH2NH2. La formule semidéveloppée de la sérotonine s'écrit HO-C8H4NH-C2H4NH2. La sérotonine est un neurotransmetteur.
La purine (un cycle pyrimidine accolé à un imidazole) est une base de Lewis.

Bases azotées et nucléotides
Dans ce qui précède, nous avons relevé le fait que certains composés aromatiques azotés avaient un caractère basique. Les bases azotées sont des molécules organiques qui jouent un rôle essentiel dans la chimie du vivant. Associées à un pentose, le ribose C5H10O5 ou le désoxyribose C5H10O4, elles constituent ce que l'on appelle un nucléoside. Ajoutez-y un à trois groupes phosphate et vous aurez un nucléotide. L'ADN (acide désoxyribonucléique) et l'ARN (acide ribonucléique) sont des chaînes de nucléotides.
Il y a 5 bases azotées dites canoniques : l'adénine (A), la cytosine (C), la guanine (G), la thymine (T) et l'uracile (U). L'ADN est formé à partir des bases A, C, T et G et l'ARN des bases A, C, G et U. Adénine et guanine sont des purines, cytosine, thymine et uracile des pyrimidines. Dans la double hélice de l'ADN, cytosine et guanine sont reliées par des ponts hydrogène ainsi qu'adénine et thymine (une purine avec une pyrimidine).

L'ADP (adénosine diphosphate) et l'ATP (adénosine triphosphate) sont quant à eux des nucléotides jouant un rôle clef dans le métabolisme des êtres vivants. Ce sont des dérivés de l'adénine.
Alcaloïdes
Les alcaloïdes sont une famille de composés organiques d'origine végétale à caractère basique (au sens chimique du terme) comportant au moins un atome d'azote. Beaucoup de ces molécules sont des hétérocycles aromatiques. La découverte des alcaloïdes au XIXème siècle a ouvert la voie à la pharmacopée moderne et à l'industrie des médicaments.
La nicotine C10H14N2 est un exemple d'alcaloïde. La nicotine est constituée d'une molécule de pyridine liée à une molécule de méthylpyrrolidine C4H8N-CH3 (l'atome d'azote de la pyrrolidine est porteur d'un groupe méthyl -CH3). La liaison entre les deux molécules se fait entre le carbone 3 de la pyridine et le carbone 2 du méthylpyrrolidine.
La caféine est également un alcaloïde, un triméthylxanthine C8H10N4O2. La xanthine C5H4N4O2 est une molécule comportant deux cycles adjacents, un cycle de six atomes et un cycle de cinq, comme la purine. Mais à la différence de la purine, la liaison délocalisée est limitée au cycle de cinq atomes qui a la structure d'un imidazole. L'autre cycle porte deux groupes cétone -C(=O)-, un groupe -NH- et un atome d'azote qui possède un doublet non liant, ce qui confère à l'ensemble un caractère de ligand (et de base de Lewis).
Citons pour finir la morphine C17H19NO3, extraite du pavot, une molécule polycyclique assez complexe.
Pour en savoir plus :
post sur les hydrocarbures
post sur les acides et les bases
post sur le carbone
post sur l'azote
post sur les bases azotées
post sur l'ADN
glossaire de chimie organique
index
#chimie#aromaticité#composé aromatique#indole#pyrrole#benzène#adénine#adn#base#acide#base azotée#nucléotide#purine#imidazole#hückel#alcaloïde#sérotonine#nicotine#caféine
0 notes
Text
Le moteur diesel
Le moteur diesel doit son nom à l’ingénieur allemand Rudolf Diesel qui le mit au point à la fin du XIXème siècle. Il est le fruit d’une lente maturation, les premiers brevets sur l’autoallumage ayant été déposés au début du XIXème siècle. Mécaniquement, le moteur diesel utilise le même assemblage de pistons, chemises, bielles et vilebrequin que le moteur à essence classique. Le moteur diesel fonctionne avec du gazole, un dérivé du pétrole composé de 75% d’alcanes (n entre 10 et 16) et de paraffines (n entre 18 et 32) et de 25% d’hydrocarbures aromatiques.
Nota : le symbole n représente le nombre d’atomes de carbone de l’alcane.
Le cycle de fonctionnement du moteur diesel est le suivant :
admission de l’air dans le cylindre mis en dépression par la remontée du piston (soupape ouverte),
compression de l’air qui s’échauffe lorsque le piston redescend, entraîné par le vilebrequin (soupape fermée),
injection du carburant sous forme de fines gouttelettes dans l’air comprimé et chaud,
combustion quasi immédiate par autoallumage,
le piston repoussé par les gaz chauds transmet une partie de son énergie à l’arbre,
échappement des gaz brûlés par la soupape lors de la remontée du piston.
L’auto inflammation du mélange résulte principalement du taux de compression élevé (entre 14:1 et 20:1) et du type de carburant utilisé. Pour mémoire, le taux de compression d’un moteur à essence est plus faible et l’allumage est réalisé par une étincelle produite par des bougies (ou par un boîtier d’allumage électronique sur les moteurs récents). L’essence quant à elle contient un forte proportion d’iso-octane C8H18.
Du fait de son taux de compression plus élevé, le moteur diesel a un meilleur rendement que le moteur à essence et produit moins de CO2 (10% de moins environ). Prenons par exemple l’hexadécane, la réaction de combustion théorique est la suivante :

Elle dégage 9951 kJ par mole d’hexadécane. En pratique et dans les conditions stœchiométriques la combustion de 1 g d’hexadécane demande 14,96 g d’air (soit 3,46 g de O2) et dégage 3,12 g de dioxyde de carbone CO2, 11,3 g de diazote (N2, présent naturellement dans l’air) et 1,35 g de vapeur d’eau.
Oxydes d’azote
Malheureusement, en raison de la forte pression et de la température dans le cylindre, l’azote se combine à l’oxygène et produit des oxydes d’azote NOx (beaucoup plus que le moteur à essence). Par ailleurs, certains noyaux de carbone libérés par la combustion se combinent pour former des particules à base d’hydrocarbures aromatiques polycycliques (HAP) ou des aldéhydes. Les particules qui se forment à l’échappement sont chargées en métaux provenant de l’usure du moteur, des additifs ou des lubrifiants. La nocivité du cocktail émis par les moteurs diesel (CO, CO2, NOx, hydrocarbures non brûlés et autres composés organiques volatils COV, HAP, particules…) ne fait plus aucun doute et a conduit à un durcissement très net de la réglementation à ce sujet. Cette nocivité avérée pourrait conduire à une interdiction progressive du moteur diesel.
Comment se débarrasser des NOx ?
Les motoristes ont travaillé dans plusieurs directions pour réduire les émissions de NOx. La première consiste à travailler sur la combustion, et en particulier sur l’injection, avec un effet réel mais limité. Une autre voie très active s’attaque aux gaz d’échappement. Renault par exemple a investi sur un système appelé Nox-trap. Qui a pour objectif de piéger les molécules d’oxyde. Les gaz d’échappement commencent par circuler dans le pot sur un catalyseur à base de platine qui transforme le monoxyde d’azote en dioxyde d’azote. Le dioxyde d’azote réagit ensuite sur de l’oxyde de baryum pour faire du nitrate de baryum Ba(NO3)2 qui reste piégé dans un dispositif spécifique. Le système doit être purgé régulièrement pour régénérer l’oxyde de baryum. D’autres constructeurs, comme Peugeot, travaille sur des dispositifs de type SCR (selective catalytic reduction). Le principe de ces dispositifs consiste à réduire les oxydes d’azote pour produire du diazote et de l’eau. On utilise pour cela le plus souvent de l’urée H2N-CO-NH2 :

La réaction se produit à 950° sans catalyseur et à 300° avec catalyseur. D’autres dispositifs utilisent directement le pouvoir réducteur de l’ammoniac :

Ces dispositifs sont efficaces : 90% dans des conditions optimales pour le système SCR. Ce rendement descend à 70% dans les dispositifs existants. Le taux de réduction dépend en effet de la température du catalyseur et du mélange entre réducteur et oxydes d’azote. Ces dispositifs sont de plus très chers. En pratique, ils ne sont adaptés que pour des installations lourdes, des camions ou des véhicules de haut de gamme.
Pour en savoir plus :
post d’introduction à la chimie
post sur le dioxyde de carbone
post sur les hydrocarbures
post sur les propriétés des hydrocarbures
post sur l’azote
post sur les oxydes d’azote
glossaire de chimie organique
index
0 notes
Text
Viscosité
A la différence d'un gaz, si les molécules au sein d'un liquide sont dans un état désordonné, elles sont néanmoins maintenues entre elles par une force de cohésion. L'énergie de cohésion d'un liquide formé de molécules est l'énergie qu'il faut lui apporter pour dissocier ces molécules de façon à les faire passer à l'état gazeux.
Les molécules qui composent un liquide sont faiblement liées entre elles, ce qui rend ce liquide déformable. La force de liaison qui les maintient dépend du type de liquide. Elle se manifeste par la résistance que ce liquide oppose à un corps solide qui cherche à le traverser. Cette résistance est mesurée par un terme appelé coefficient de viscosité. Plus la viscosité d'un liquide est grande, plus il est difficile à traverser. L'inverse de la viscosité est la fluidité. Un liquide dont la viscosité est nulle est dit superfluide. L'hélium est superfluide en dessous de 2 K.
Viscosité dynamique
La viscosité dynamique d'un liquide se définit comme suit. Considérons deux couches très minces de ce liquide, parallèles entre elles et espacées d'un intervalle dz. Supposons que l'on cherche à déplacer la couche supérieure parallèlement à la couche inférieure. Les forces de liaison qui s'exercent entre les molécules tendent à s'opposee à ce mouvement. Leur résultante est assimilable à une force de frottement (frottement visqueux). Cette force peut s'écrire :

Dans cette formule le terme dv/dz est le taux de cisaillement. On comprend intuitivement que la vitesse relative des couches parallèles augmente en fonction de leur distance. S est la surface de la couche et mu est la viscosité dynamique, qui s'exprime en kg.m-1.s-1, ou encore en Pa.s (Pascal.seconde). La viscosité cinématique s’obtient en divisant mu par la masse volumique du liquide. L’unité de viscosité cinématique est le Stokes (St).
A 20°C, l’eau a une viscosité de 1.10-3 Pa.s et l’air de 1,8 10-5 Pa.s. Si l’on excepte les résines thermodurcissable, la viscosité diminue avec la température. Pour les liquides courants, on utilise plutôt comme unité le mPa.s (millipascal.seconde). A 20°C, l’essence est moins visqueuse que l’eau (0,65 mPa.s) et le mercure à peine plus (1,55 mPa.s). Le sang est modérément visqueux : 6 mPa.s en moyenne. Avec l’huile d’olive on entre dans la catégorie des liquides dont la viscosité est nettement perceptible : 84 mPa.s. Et que dire du miel liquide et de ses 6000 mPa.s ! Les substances pâteuses ont une viscosité qui s’exprime en kPa.s, voire en mégaPa.s. Le bitume à 20°C a une viscosité de 100 MPa.s !
Le verre peut être considéré comme un liquide dont la viscosité est infinie.
Pour en savoir plus :
post sur la cohésion des solides
post sur le verre et les solides amorphes
index
0 notes
Text
Orbitales moléculaires
Pour comprendre la structure des atomes et les liaisons intramoléculaires, il est indispensable d’avoir recours à la mécanique quantique. C’est la formulation du principe de dualité onde-particule par Louis de Broglie et l’énoncé de l’équation de Schrödinger peu de temps après qui ont ouvert la voie aux différentes théories qui ont progressivement permis de mieux comprendre les liaisons chimiques et la cohésion de la matière.
Les travaux de Schrödinger et de de Broglie ont permis de dépasser les difficultés attachées à la représentation des électrons comme de petites billes orbitant autour du noyau qu’avait proposée Niels Bohr au cours des années 1910. Cette représentation conduisait en effet à un paradoxe insoluble : les électrons devaient inéluctablement tomber sur le noyau du fait du rayonnement synchrotron. Ce modèle a fait place à celui des orbitales atomiques (OA) qui découle de l’application de l’équation de Schrödinger au potentiel coulombien du noyau d’un atome. :

Si l’on recherche les solutions stationnaires de cette équation, on constate que celles-ci sont quantifiées. Les électrons d'un atome ne peuvent occuper que certains niveaux d'énergie et leur position dans l’espace est décrite par une fonction d’onde solution de cette équation. Géométriquement, cette fonction d’onde est représentée par un volume en 3D à l’intérieur duquel on a le plus de chance de trouver l’électron considéré.
Orbitales atomiques de l’atome d’hydrogène
L’atome d’oxygène est le seul atome pour lequel nous ayons une solution analytique de l’équation de Schrödinger. On peut montrer que la forme d’onde des orbitales de l’atome d’hydrogène est décrite par la série des harmoniques sphériques.
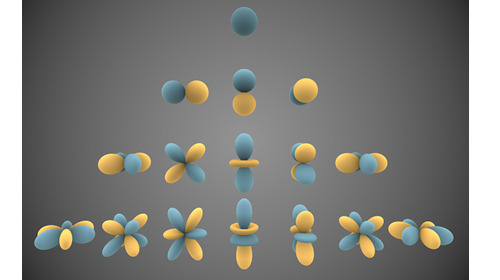
Image générée par Inigo Quilez, licence Creative Commons Attribution Share Alike 3.0 Unported.
Ces harmoniques sont caractérisées par trois nombres entiers que l’on nomme par convention n, l et m. Le nombre n est le nombre quantique principal. C’est un nombre entier strictement positif. Le nombre l est le nombre quantique azimutal. C’est un nombre entier positif ou nul strictement inférieur à n. Un même nombre l désigne plusieurs orbitales d’orientation et éventuellement de forme différentes et qui sont référencées par le troisième nombre quantique (noté m). Le nombre m est un nombre entier supérieur ou égal à -l et inférieur ou égal à l. Une même orbitale ne peut être occupée que par deux électrons de spin différent (principe d’exclusion de Pauli).
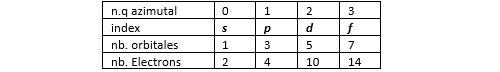
En chimie, on préfère utiliser une autre terminologie. On associé aux orbitales correspondant au même couple (n, l) un index composé d’un chiffre (le nombre quantique principal n) et d’une lettre. La lettre s correspond à l = 1, la lettre p à l = 2, la lettre d à l = 3 et la lettre f à l = 4. Lorsqu’on a besoin de distinguer les différentes orbitales associées à un même index, on utilise un indice caractérisant la géométrie de la forme d’onde considérée.

On dit des électrons ayant le même nombre quantique principal qu’ils appartiennent à une même couche et à ceux qui occupent des orbitales caractérisées par le même couple (n, l) qu’ils appartiennent à une même sous-couche.
Dans le cas d’un atome comportant plusieurs électrons, il n’est pas possible de trouver une solution analytique de l’équation de Schrödinger. On procède dans ce cas par approximation, couche par couche, en faisant l’hypothèse que la couche de niveau inférieur fait écran à ce qui se passe plus près du noyau. Ainsi, pour la couche la plus éloignée du noyau (celle dont les électrons sont susceptibles de participer à une liaison chimique avec un autre atome), tout se passe comme s’ils orbitaient autour d’un pseudo-noyau que l’on pourrait qualifier d’hydrogénoïde.
Remplissage des couches et règle de Klechkowski
Les 2l+1 orbitales qui ont le même nombre quantique n et le même nombre quantique l ont la même énergie. On parle de dégénérescence des niveaux d’énergie pour ces orbitales. Les orbitales p par exemple sont 3 fois dégénérées et les orbitales d 5 fois.
La règle de Klechkowski stipule l’ordre dans lequel les sous-couches sont occupées : 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p... On remarquera que la règle de Klechkowski fait une entorse à la logique croissante des nombres quantiques principaux. Ainsi, par exemple, la sous-couche 3d s’intercale entre la sous-couche 4s et la sous-couche 4p. Les énergies des niveaux 4s, 3d et 4p sont en effet assez voisins. Idem au niveau des couches 5 et 6. La règle de Klechkowski conduit donc à redéfinir la notion de couche comme suit.

Au sein d’une même sous-couche, les électrons se répartissent de façon à occuper le maximum d’orbitales (ou, ce qui revient au même, à minimiser le nombre d’orbitales complètement remplies). On appelle bande de valence la dernière couche (au sens de Klechkowski) qui est remplie. Pour caractériser le remplissage des couches électroniques d’un atome, on énumère les sous-couches de sa bande de valence en indiquant en exposant le nombre d’électrons qui les occupent. Exemple : le carbone a 6 électrons. Sa couche 1 est complètement remplie (2 électrons) et il possède 4 électrons sur sa couche 2. La configuration de sa bande de valence est 2s2, 2p2. Le fer a 26 électrons. Ses couches 1, 2 et 3 sont occupées. La configuration de sa bande de valence est 4s2, 3d6.
Formes d’onde
Il est important pour la suite de ce post d’avoir une idée de la forme d’onde des orbitales. Nous nous limiterons aux orbitales de type s, p et d. Les orbitales s sont des orbitales de symétrie sphérique. Les orbitales p sont de symétrie axiale. La fonction d’onde change de signe lorsqu’on traverse le plan perpendiculaire à l’axe de symétrie (représentation grisée sur la figure).
.
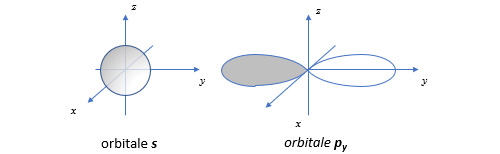
Passons aux orbitales d. Considérons par exemple l’orbitale dyz dans la figure ci-dessous. A rayon constant, l’amplitude de la fonction d’onde est proportionnelle au produit de y et z. Les plans xOy et xOz sont des plans nodaux (amplitude nulle). Les orbitales dxy et dxz se déduisent de dyz par permutation des coordonnées. L’orbitale dx2-y2 a une forme d’onde similaire mais orientée de façon différente par rapport aux axes (attention : sur la figure le plan xOy est cette fois dans le plan de l’écran). L’orbitale dz2 a une allure très différente. L’amplitude de la fonction d’onde est maximale sur l’axe Oz et toujours positive. Elle est par contre négative dans le plan xOy . Elle possède une surface nodale qui est un cône d’équation :

L’angle au sommet du cône est égal à 109,5◦ (valeur qui est celle de l’angle d’un tétraèdre).

Orbitales moléculaires
La théorie des orbitales moléculaires (TOM) a pour but de décrire la forme d’onde des orbitales dans le cas d’une molécule comportant des liaisons covalentes (orbitales moléculaires). L’équation de Schrödinger continue alors de s’appliquer mais la recherche de solutions se complique sérieusement. Si, dans le cas d’un atome isolé, on pouvait se contenter de ne prendre en compte que le potentiel coulombien du noyau, ce n’est en effet plus suffisant si l’on est en présence de plusieurs noyaux.
Nota : la TOM s’appuie sur les travaux précurseurs de Friedrich Hund et Robert Mulliken.
Pour résoudre l’équation de Schrödinger en présence de plusieurs noyaux, la TOM fait l’hypothèse que les solutions s’expriment sous la forme d’une combinaison linéaire des solutions de cette équation pour chacun des atomes qui la constituent :

Cette théorie (qui n’est elle-même qu’une approximation) fonctionne assez bien dans des cas simples comme celui d’une molécule diatomique ou d’une molécule présentant un certain degré de symétrie autour d’un atome ou d’un ion central. Dans le cas de la liaison covalente entre deux atomes, cette combinaison peut s’écrire :

La figure qui suit illustre l’application de cette théorie à la liaison O-H dans la molécule d’eau. La bande de valence de l’hydrogène est 1s1, celle de l’eau 2s2, 2p4. On peut montrer que la combinaison linéaire des orbitales 1s de l’hydrogène et 2p de l’oxygène conduit à deux solutions notées sigma et sigma*. La première décrit une orbitale moléculaire liante (OM liante) dont le niveau d’énergie est plus faible que celui des orbitales atomiques d’origine. L’autre décrit une OM antiliante dont le niveau d’énergie est plus élevé que celui des orbitales d’origine.
Dans le cas de l’OM liante les coefficients alpha et béta s’ajoute. Il y a une zone de recouvrement des OA. Les deux électrons cohabitent « pacifiquement ». Comme le domaine qui leur est alloué est plus étendu, leur énergie totale est moindre (c’est une conséquence du principe d’indétermination d’Heisenberg, voir le post sur les électrons). L’énergie du doublet d’électrons étant plus basse que l’énergie des électrons lorsque les atomes sont séparés, cette configuration est stable. Le différentiel d’énergie est appelé énergie de liaison.
Dans le cas de l’OM antiliante, les coefficients se soustraient et il y a au contraire une zone d’exclusion. Les électrons sont repoussés dans un volume plus confiné. Leur énergie totale est plus élevée. Cette configuration est déstabilisante pour la liaison entre les atomes puisque son énergie est plus élevée que lorsqu’ils sont séparés.

Dans la molécule d’eau l’oxygène entretient deux liaisons de ce type. Compte tenu de la géométrie des orbitales 2p, on pourrait s’attendre à ce que l’angle HOH soit de 90 degrés. Dans les faits, la répulsion coulombienne entre les noyaux H+ augmente cet angle qui est en réalité de 104,5 degrés. La molécule d'hydrogène sulfuré H2S a présente une configuration similaire. Ceci n'a rien d'étonnant puisque la bande de valence du soufre (3s2, 3p4) a la même configuration que celle de l'oxygène. Mais l'atome de soufre est plus gros que l'atome d'oxygène. La distance H-S est donc supérieure à la distance H-O (133,6 pm vs. 95.8 pm). De ce fait, la répulsion coulombienne est moins importante et l'angle HSH est plus proche de l'angle droit (92.1 degrés).
Recouvrement sigma et recouvrement pi
Dans l’exemple qui précède (liaison O-H au sein d’une molécule d’eau) le recouvrement des orbitales était axial. Un tel recouvrement porte le nom de recouvrement sigma. Ce n’est pas nécessairement le cas. Lorsqu’une liaison sigma existe déjà, elle peut être complétée par une liaison pi entre des orbitales p perpendiculaires par rapport à l’axe qui joint les deux atomes. Cette liaison forme en quelque sorte un pont entre les atomes. C’est typiquement le cas lors d’une liaison double comme la liaison C=C de l’éthylène.

Le mode de recouvrement le plus courant reste cependant le recouvrement sigma. La figure qui suit illustre la liaison covalente entre l’argent et une molécule d’ammoniac dans le complexe Ag(NH3)2. La liaison se fait entre l’orbitale dy2 du métal et une orbitale 3p de l’azote dans une molécule d’ammoniac. (Les orbitales 1s des trois atomes d’hydrogène sont représentées par de petites boules grises.)

Le deuxième exemple illustre une liaison pi entre l’orbitale dyz d’un métal et une orbitale pi d’un halogénure. Le troisième exemple est celui d’une liaison sigma-pi. L’orbitale moléculaire se forme à partir d’une liaison pi existante que vient capter l’orbitale inoccupée d’un cation métallique (ion trichloro éthylène platine [PtCl3(C2H4)]-, l’orbitale dz2 du platine capte l’orbitale pi de l’éthylène).
Exemple de liaison double : la molécule dioxygène
La molécule dioxygène comporte une liaison double qui mérite d’être étudiée car elle va nous permettre d’approfondir différents aspects de la liaison covalente. La bande de valence de l’atome d’oxygène a pour configuration (2s2, 2p4). Dans la sous-couche 2px, un doublet occupe l’orbitale 2px et les deux électrons restants se répartissent sur 2py et 2pz (règle de Hund). Construisons le diagramme des orbitales moléculaires de la molécule dioxygène (figure ci-dessous). Les deux orbitales 2s tout d’abord vont, en se recouvrant, former un orbitale liante sigma_s et une orbitale antiliante sigma_s*. A l’origine, les deux fois trois orbitales 2p ont la même énergie. Par contre, seules les orbitales 2px pointent l’une vers l’autre. Elles sont les seules à se recouvrir. Elles vont former vont former un orbitale liante sigma_px et une orbitale antiliante sigma_px*. Les orbitales 2py et 2pz sont parallèles entre elles. Elles vont former chacune un jeu d’orbitales pi liantes (pi_py et pi_pz) et antiliantes (pi_py* et pi_pz*) de même énergie. Répartissons maintenant les deux fois six électrons dans ces orbitales. La règle de Klechkowski s’applique pour les niveaux de plus basse énergie. Les orbitales sigma_s, sigma_s*, sigma_px, pi_py, pi_pz sont remplies. Il reste deux électrons à disposer sur le niveau d’énergie le plus élevé. Comme on le voit sur le diagramme, il est dégénéré (les deux orbitales pi_py* et pi_pz* ont le même niveau d’énergie). Cette fois c’est la règle de Hund qui s’applique. Il y a donc un électron célibataire sur chaque.
Remarque : rappelons que la règle de Hund spécifie que la répartition des électrons doit minimiser le nombre de paires appariées.

Ordre de liaison
Aïe... Nous voilà avec 4 orbitales liantes sur les bras alors que nos cours de chimie (ou le modèle des orbitales hybrides présenté précédemment) claironnent que la molécule de dioxygène est basée sur une liaison double. Liaison double qui permet à ladite molécule de satisfaire à la règle de l’octet (les 4 orbitales de la bande de valence des atomes d’oxygène remplies). La TOM serait-elle fausse ? Pourtant, elle permet d’expliquer une propriété tout à fait étonnante du dioxygène : son caractère paramagnétique. Ce sont en effet les deux électrons célibataires des orbitales pi_py* et pi_pz* qui permettent d’expliquer le paramagnétisme du dioxygène, propriété inexplicable dans le cadre de la théorie classique des liaisons covalentes. Alors, liaison double ou quadruple ?
Cet apparent paradoxe nous renvoie au caractère artificiel d’une théorie. Une théorie est une construction abstraite qui a pour objectif de nous aider à nous représenter la nature des phénomènes physico-chimiques et d’en prédire les caractéristiques mesurables. N’en déplaise à certains philosophes des sciences comme Max Tegmark, une théorie n’est pas l’essence profonde du réel. Le réel n’est pas l’image projetée sur l’écran de nos perceptions par une machine déroulant un programme. Comme toute construction mentale, une théorie ne peut pas embrasser entièrement la complexité du réel. Elle comporte des approximations et elle a une précision et un domaine de validité limité. Prenons le modèle des orbitales hybridées sur lequel est construit la représentation bien commode des orbitales simples, doubles ou triples. Il est incapable, par exemple, de prédire le caractère polaire d’une molécule comme le chlorométhane CH3Cl. Il faut le rafistoler en ayant recours à la règle de Bent (voir le post sur la géométrie des orbitales).
Mais comment concilier l’écart flagrant entre le nombre d’orbitales liantes prédit par la TOM et la représentation sous forme de liaison double qu’enseigne les chimistes ? C’est la notion d’ordre de liaison qui permet de faire le lien. Dans le modèle classique, on fait l’hypothèse que la stabilité de la molécule repose sur deux orbitales liantes et que les orbitales dites non liantes n’ont aucun effet. Dans la TOM, c’est différent. Certes, il y a 4 orbitales liantes... mais il y a aussi trois orbitales antiliantes dont l’une est entièrement occupée. Or une orbitale antiliante est, par nature déstabilisante. Elle tend à affaiblir la liaison. C’est ce que traduit l’ordre de liaison. L’ordre de liaison est la demi-différence entre le nombre d’électrons liants et le nombre d’électrons antiliants. Dans le cas du dioxygène, il y a 8 électrons liants et 4 antiliants. On a donc bien un ordre de liaison égal à 2.
Remarque : nous avons représenté le spin des deux électrons célibataires dans le même sens. On donne à cette configuration le nom d’état triplet. Si on mesure le spin résultant selon un axe, la mécanique quantique prévoit en effet que l’on peut obtenir 3 valeurs : +1, 0, -1, la valeur 0 signifiant que le spin est orthogonal à la direction dans laquelle on effectue la mesure. Si les deux spins pointaient dans des directions opposées, le spin résultant serait obligatoirement nul et on aurait alors un état singulet (voir le post sur la notion de spin). (voir le post sur notion de spin).
Composé polyatomique
Lors de la formation d’un composé polyatomique, la constitution des OM dépend essentiellement de la géométrie et des symétries de ce composé. Les composés dits complexes sont intéressants à cet égard. Ils se forment entre un métal de transition et des ligands. Un ligand peut être un atome ou une molécule qui dispose d’un doublet d’électrons non liants (non engagés dans une autre liaison), un radical (une espèce chimique qui possède un électron non apparié) ou encore un anion.
Les métaux de transition sont des éléments chimiques qui appartiennent au bloc d de la classification périodique des éléments. Cela veut dire que leur couche de valence (la couche de plus haute énergie qui soit occupée) est de type ns2, (n-1)dx ou ns1, (n-1)dx. Le fer (4s2, 3d6) en est l’élément le plus emblématique mais cette famille comporte 37 autres éléments comme le titane (4s2, 3d2), le chrome (4s1, 3d5), le cuivre (4s1, 3d10), le tantale (6s2, 5d3) ou l’or (6s1, 5d10). Uu grand nombre de ces éléments forment des complexes octaédriques, comme l’hexacorbonyle de chrome Cr(CO)6, l’hexaaquo titane Ti(H2O)63+ ou le dichloro tetraammine cobalt [CoCl2(NH3)4]+. Les complexes à structure octaédrique permettent de bien comprendre comment se forment les OM dans un composé polyatomique.

La théorie des groupes de symétrie (dans le cas que nous allons étudier le groupe de symétrie octaédrique Oh) permet de construire les OM en faisant un certain nombre d’hypothèses simplificatrices qui sont aisément justifiables. Les orbitales du métal qui sont concernées sont les orbitales ns, (n-1)d et np. Leur combinaison avec le groupe Oh conduit à établir le diagramme qui suit sur la base de recouvrements sigma.
L’orbitale ns se débouble pour donner les OM a1g et a1g* (dénomination issue de la théorie des groupes de symétrie). L’orbitale a1g est liante et l’orbitale a1g* est antiliante. (Par la suite les orbitales antiliantes seront toujours repérées par un astérisque.) Idem pour les 3 orbitales p qui donnent les OM t1u et t1u* qui sont triplement dégénérées. Pour les 5 orbitales d, il y a levée partielle de la dégénérescence. Les lobes des orbitales dxy, dxz et dyz ne sont pas orientés dans l’axe des ligands (voir le schéma plus haut). Ils pointent à 45 degrés par rapport à cet axe. Ces orbitales sont non liantes. Dans notre diagramme elles sont représentées par les orbitales t2g de même énergie. Les orbitales dx2-y2 et dz2 présentent quant à elles la bonne symétrie. Elles donnent les OM eg et eg*. Le niveau d’énergie de ces OM n’est plus le même que celui des orbitales t2g. Dans un cas il y a interaction et dans l’autre non.
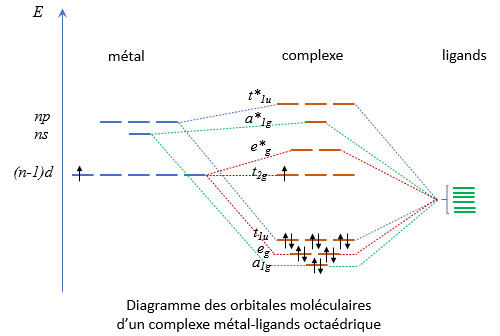
Nota : en géométrie tétraédrique, la situation des orbitales dxy, dxz et dyz et orbitales dx2-y2 et dz2 est inversée. Cette fois ce sont les orbitales t2 qui pointent vers les ligands.
Dans ce qui précède, on a fait l’hypothèse implicite que tous les ligands étaient de même nature. Ce n’est nullement une obligation et il existe de nombreux complexes combinant des ligands différents, comme par exemple le dichloro tetraaquo fer PtCl2(NH2)2 ou le triammino trinitro chrome Cr(NH3)3(NO2)3. Dans ce cas la structure est déformée pour tenir compte des différences d’encombrement et d’énergie de liaison des ligands.
Liaison délocalisée
Jusqu’à présent, nous n’avons considéré que des orbitales moléculaires englobant deux atomes. Mais rien n’empêche la formation d’une orbitale plus étendue. Prenons le cas du buta-1,3-diène H2C=CH-CH=CH2. Considérons dans un premier temps la liaison double C=C qui constitue l’épine dorsale d’une molécule d’éthylène. Elle est composée d’une liaison sigma et d’une liaison pi. L’interaction entre les OA qui conduisent à la liaison pi se traduit par deux OM, un OM liante et une OM antiliante. Supposons maintenant que nous rapprochions les deux molécules d’éthylène que nous allons considérer comme des sous-systèmes possédant chacun deux niveaux d’énergie (on fait ici abstration des liaisons sigma). Si l’on applique la TOM à ces deux sous-systèmes, on va de nouveau avoir un dédoublement OM liante / OM antiliante pour chacun des niveaux (voir la figure ci-dessous). Ceci va se traduire par la formation de quatre orbitales. Une orbitale d’énergie minimale englobant les quatre atomes de carbone, une orbitale d’énergie légèrement supérieure, que l’on pourra qualifier de liante/antiliante/liante, une troisième orbitale antiliante/liante/antiliante et une quatrième, d’énergie maximale, complètement antiliante.

Remarque : la figure ci-dessus est une illustration. Elle n’a pas la prétention de représenter la forme d’onde des orbitales... qui, en l’occurence, sont des orbitales pi.
Il y a quatre électrons à caser : ils ne peuvent pas tous occuper l’orbitale d’énergie la plus basse (principe d’exclusion de Pauli). Un doublet d’électrons occupera la première orbitale et le deuxième la seconde. Ce qui signifie que l’un des doublets est délocalisé sur toute la chaîne carbonée. Mais si les électrons de ce doublet peuvent se balader sur toute la chaîne, il est impossible d’attribuer le deuxième doublet à l’un ou l’autre des deux lobes de la deuxième orbitale ! Ils sont donc eux aussi délocalisé même si la zone du milieu leur est interdite. Comment passe-t-il d’un côté à l’autre ? Par effet tunnel, une des propriétés étranges de la mécanique quantique.
La délocalisation est également à l’œuvre dans la molécule du benzène C6H6. La molécule de benzène est basée sur un hexagone dont chaque sommet est occupé par un atome de carbone. Chaque atome de carbone entretient une liaison covalente avec ses deux voisins carbone et une avec un atome d’hydrogène. Compte tenu de la valence du carbone, on pourrait s’attendre à ce que les 6 atomes de carbone se regroupent deux à deux pour former des liaisons pi entre eux. Chaque atome de carbone entretiendrait donc deux liaisons covalentes sigma C-C, une liaison sigma C-H et une liaison pi C-C. Mais pourquoi la liaison pi s’établirait-elle plutôt avec le voisin de gauche qu’avec le voisin de droite d’un atome de carbone ? Du point de vue de la fonction d’onde solution de l’équation de Schrödinger, la probabilité est équivalente. La liaison pourrait donc sauter de l’un à l’autre de manière aléatoire. Tout comme dans le cas du butadiène on est en présence d’une liaison pi délocalisée. Chaque atome de carbone engage un électron dans cette liaison qui s’étend à tout l’hexagone. Six électrons sont donc mis en commun dans cette liaison qui est la caractéristique des molécules organiques dites aromatiques.
Liaison iono-covalente
Revenons à la théorie des orbitales moléculaires dans le cas diatomique. Nous avons dit que la fonction d’onde de l’orbitale moléculaire était une combinaison linéaire des orbitales atomiques d’origine. Dans l’équation de l’OM reproduite plus haut, les coefficients alpha et béta indiquent dans quelle proportion ces orbitales se combinent. Supposons que l’atome numéro 1 soit beaucoup plus électronégatif que l’atome numéro 2. Dans ce cas, alpha sera proche de 1 et béta beaucoup plus faible. Cela signifie que les électrons du doublet auront tendance à se réfugier dans l’orbitale atomique du premier atome. A la limite, si alpha était égal à 1, on se retrouverait dans le cas d’une liaison ionique. On appelle ce type de liaison une liaison iono-covalente. Elle se traduit par l’apparition d’un dipôle électrique dans la mesure où l’un des atomes est porteur d’une charge électrique négative et l’autre d’une charge électrique positive. C’est d’ailleurs le cas pour la liaison O-H. Compte tenu de la configuration géométrique de la molécule d’eau qui n’est pas linéaire, cette polarisation électrique se retrouve au niveau de la molécule, ce qui fait de l’eau une molécule polaire.
Occupation des orbitales, couleur et propriétés magnétiques des complexes
Dans un atome, la règle de Hund stipule que les électrons de la couche de valence se répartissent sur les différentes orbitales de façon à minimiser le nombre d’électrons appariés. Cela résulte du fait que l’appariement des électrons (c.à.d le fait deux électrons de spin opposé occupent la même orbitale) a un coût énergétique. Dans un composé complexe cela dépend de l’écart d’énergie entre les orbitales. Si le coût énergétique de l’appariement des électrons est supérieur à cet écart, les électrons auront effectivement tendance à se répartir entre les niveaux pour minimiser l’énergie totale du système. La règle de Hund sera dans ce cas respectée. Si ce n’est pas le cas, elle ne le sera pas (c’est la situation dans la figure ci-dessus). On caractérise ces deux situations en disant que la première est de type champ faible – spin fort et la seconde champ fort - spin faible. Si les électrons sont répartis de façon à maximiser le nombre d’électrons non appariés on aura un matériau paramagnétique, c’est-à-dire susceptible de présenter un magnétisme rémanent. Dans le cas contraire, le matériau est diamagnétique : le champ rémanent est faible.
En général, un complexe champ fort – spin faible est incolore. Le delta d’énergie pour faire passer un électron sur un niveau orbitalaire d’énergie supérieure est trop élevé pour que le photon correspondant soit dans le domaine visible. A contrario, un complexe champ faible – spin fort présente une coloration franche. De tels complexes sont d’ailleurs à la base de nombreux pigments.
La notion de composé complexe et de ligand est détaillée dans plusieurs posts : complexes et ligands, complexes et ligands - une autre approche, exemples de complexes et de ligands.
Pour en savoir plus :
post sur l’équation de Schrödinger
post sur le spin
post sur les électrons
post sur la classification périodique des éléments
post sur les liaisons chimiques
post sur la valence
post sur la géométrie des molécules
post sur la cohésion de la matière
post sur les complexes et les ligands : approche ionique
post sur les complexes et les ligands : approche covalente
post sur les matériaux magnétiques
index
#orbitale#chimie#covalence#liaison chimique#liaison covalente#hund#atome#quantique#électron#liaison sigma#liaison pi#ligand#complexe#cation#minéral
0 notes
Text
Les roches métamorphiques
Une roche métamorphique est une roche qui résulte de la transformation d’une roche magmatique ou sédimentaire ou d’une autre roche métamorphique sous l’action d’une pression et d’une température très élevées.
Le métamorphisme peut résulter de différents types de phénomènes géologiques :
le métamorphisme régional se forme lors de grands mouvements de subduction ou d’orogénèse (formation de montagnes),
le métamorphisme cataclastique caractérise des épisodes de métamorphisme rapides à une échelle géologique,
le métamorphisme de contact se produit au contact d’une poche de magma,
le métamorphisme de choc est produit par l’impact d’une météorite.
Faciès métamorphique
La transformation métamorphique induit une modification de la texture, de l’assemblage (transition de phase) et même de la composition chimique de la roche d’origine. Des conditions de température et de pression différentes conduisent en effet à un assemblage minéralogique (arrangement des cristaux de base) différent et une composition chimique différente. Ceci a conduit le géologue Pentti Eskola à introduire la notion de faciès métamorphique. A chaque faciès correspond un assemblage minéralogique.
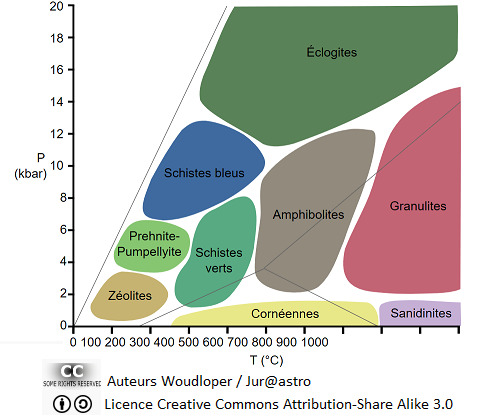
Nota : la différence de composition chimique peut s’expliquer en prenant un exemple. Les amphibolites et les zéolites ne cristallisent pas à la même température. La cristallisation préalable des amphibolites modifie la teneur du magma qui s’appauvrit en certains minéraux. Les zéolites qui cristallisent plus tard n’ont donc mas la même composition.
Un même processus géologique peut induire des faciès métamorphiques différents.

Types de roches métamorphiques
On utilise de façon plus courante un autre type de classification des roches métamorphiques, classification basée sur une observation de leurs caractéristiques structurelles et de leur composition chimique. On distingue de la sorte quatre grandes catégories de roches métamorphiques :
les schistes,
le gneiss,
le marbre,
les métabasites.
Les schistes métamoprhiques (il existe des schistes sédimentaires) proviennent de la transformation d’argile. Les schistes ont un aspect feuilleté très marqué et on peut les débiter en plaques. L’ardoise et la lauze sont des schistes.
Le gneiss est une roche qui résulte de la transformation métamorphique du granite (orthogneiss) ou de l’argile (paragneiss). Le gneiss est composé de feldspath (principalement plagioclase), de quartz, de mica et d’amphibole sous forme de grains suffisamment gros pour qu’on les distingue à l’œil nu. La foliation du gneiss est également très visible. La matière qui constitue les feuillets semble avoir été étirée, comme laminée par le processus métamorphique. Le gneiss est très présent dans la croûte continentale.
Le marbre est une roche issue de la transformation métamorphique du calcaire. Le marbre présente une schistosité à peine visible, qui est une direction préférentielle des cristaux qui le composent et qui est mise à profit par les carriers lors de l’extraction.
La catégorie de métabasites englobe les métabasaltes et les métagabbros, des roches issues de la transformation métamorphique du basalte et du gabbro, deux roches magmatiques. Le basalte est une roche volcanique, qu’on trouve à proximité des reliefs volcaniques ou dans la croûte océanique. Le basalte a une structure microlitique (cristaux formant de petits bâtonnets, les microlites), noyés dans une pâte vitreuse. Le basalte est composé de feldspath plagioclase(environ 50%), de pyroxène, d’olivine et de quelques pourcents de magnétite. Le gabbro est une roche plutonique composée principalement de pyroxène et de feldspath plagioclase. C’est une roche grenue (composée de grains visibles à l'œil nu et non orientés). Le gabbro est le constituant principal de la croûte océanique.
Pour en savoir plus :
post sur la Terre
post sur la géologie de la croûte terrestre
post sur les cristaux
post sur les cristaux (suite)
post sur des exemples de cristaux
post sur le verre
post sur les roches sédimentaires
post sur les roches magmatiques
post sur les silicates
post sur les carbonates
post sur l’aluminium
post sur l’argile
post sur le calcium
post sur le magnésium
post sur la cohésion de la matière
glossaire de chimie minérale
index
1 note
·
View note
Text
Les roches magmatiques
Les roches magmatiques sont des roches qui se forment lorsque le magma se refroidit plus ou moins rapidement en se solidifiant. Cette solidification s’accompagne d’une cristallisation totale ou partielle. La taille des grains cristallins dépend de la vitesse de refroidissement du magma. Inférieurs à 1 mm on les appelle des microlithes ou des sphérulites. Les roches contenant ce types de microcristaux sont dites microlithiques. Au-delà de 2 mm on dit qu’elles sont grenues. Les roches magmatiques représentent l’essentiel de la masse de la croûte terrestre, même si, en surface, les roches sédimentaires peuvent occuper de larges espaces.
Roches plutoniques
Les roches magmatiques plutoniques se forment en profondeur. On les appellent également roches intrusives. Les roches plutoniques peuvent être totalement cristallisées mais le plus souvent elles ont une texture grenue. Elles comportent des phénocristaux (des cristaux visibles à l’œil nu) dans une matrice remplie de microlites (des microcristaux) cimentés entre eux.
Le granite est une roche plutonique. Près de 90% des roches plutoniques qui composent la croûte continentale sont des granites. Le granite est riche en quartz et en feldspath alcalin (en particulier en orthose). Il comporte également une proportion plus ou moins importante de mica et de feldspath plagioclase, mais aussi des traces de hornblende, de magnétite, d’apatite, de grenat ou de zircon. La composition chimique moyenne du granite est de 75% de silice, 14% d’alumine et 11% d’oxydes.
Le gabbro est également une roche plutonique, composée principalement de pyroxène, d’olivine et de feldspath plagioclase. On le trouve plutôt dans la croûte océanique. Le gabbro se distingue des granites par ses gros grains. Si le granite peut avoir des couleurs très diverses, le gabbro est généralement noir avec des nuances vertes.
Si on classe les roches plutonique en fonction du type de feldspath qui les constitue (alcalin vs. plagioclase), le granite et le gabbro sont aux deux extrémités. Entre deux, on trouve trois autres catégories :
La syénite est composée de feldspath alcalin, de hornblende et de biotite (un mica). Elle ne comporte pas de quartz.
La granodiorite est, en quelque sorte, un granite qui comporte plus de feldspath plagioclase que de feldspath alcalin.
La diorite est composée principalement de feldspath plagioclase et d’amphibole et ne comporte ni quartz ni olivine.
Roches volcaniques
Les roches magmatiques volcaniques quant à elles remontent à la surface où elles refroidissement au contact de l’air ou de l’eau (roches effusives ou extrusives). Ce refroidissement produit un effet similaire à celui de la trempe, ce qui explique que ces roches soient partiellement vitreuses (on parle de roches hyalines).
Le basalte est une roche volcanique, qu’on trouve à proximité des reliefs volcaniques ou dans la croûte océanique. Le basalte a une structure microlitique (cristaux formant de petits bâtonnets, les microlites), noyés dans une pâte vitreuse. Le basalte est composé de feldspath plagioclase (environ 50%), de pyroxène, d’olivine et de quelques pourcents de magnétite. Sa composition est relativement proche de celle du gabbro. Le basalte représente 90% des roches volcaniques.
La rhyolite est riche en silice (on dit d’elle qu’elle est aux roches volcaniques ce que le granite est aux roches plutoniques). C’est une roche claire qui présente de gros cristaux de quartz et de feldspath. L’obsidienne est une variété de la rhyolite presque entièrement vitrifiée.
Si on reprend la même classification que pour les roches plutoniques, avec la rhyolite et le basalte aux deux extrémités, on va trouver :
la trachyte, riche en feldspath alcalin est pauvre en quartz (moins de 10%),
la rhyodacite, dans laquelle les feldspaths plagioclases sont plus abondants,
l’andésite, une roche volcanique composée de phénocristaux de feldspath plagioclase, de hornblende et d’amphibole pris dans une pâte vitreuse.

Pour en savoir plus :
post sur la Terre
post sur la géologie de la croûte terrestre
post sur les cristaux
post sur les cristaux (suite)
post sur des exemples de cristaux
post sur le verre
post sur les roches sédimentaires
post sur les roches métamorphiques
post sur les silicates
post sur l’aluminium
post sur la cohésion de la matière
glossaire de chimie minérale
index
#géologie#basalte#granite#gabbro#andésite#pyroxène#feldspath#plagioclase#orthose#amphibole#rhyolite#magma#magmatique#sédimentaire#plutonique#microlite#phénocristaux
1 note
·
View note
Text
Géologie de la croûte terrestre
La croûte terrestre est la partie superficielle de la lithosphère. Elle est séparée du manteau supérieur par la discontinuité de Mohorovicic (ou Moho) caractérisée par une nette différenciation des caractéristiques du milieu et de la propagation des ondes sismiques. La croûte continentale (les terres émergées et la plateau continental) a une épaisseur qui varie entre 20 et 90 km (35 km en moyenne). L’épaisseur de la croûte océanique est inférieure à 10 km. La densité moyenne est comprise entre 2,7 et 2,8 g/cm3.
Composition de la croûte terrestre
La croûte terrestre est composée presque exclusivement d’oxydes. Le géologue Franck Clarke a établi une liste des principaux oxydes présents et de leur abondance en pourcentage de la masse totale.

Cette répartition a un caractère quelque peu artificiel. Dans la réalité, ces oxydes, à quelques exceptions près (comme le quartz), ne se rencontrent pas à l’état pur dans la croûte terrestre. Les composés qui forment l’essentiel de la composition de la croûte terrestre sont des silicates et des aluminosilicates. Les carbonates (calcaires, dolomies) n’en constituent qu’une petite partie mais ils sont assez bien représentés en surface. Ces minéraux sont présents sous différentes formes : quartz, feldspath, olivine, pyroxène, amphibole, mica, calcite... chacune de ces dénominations correspondant à une composition et à un arrangement cristallin donnés.
Structure des matériaux
Cette liste ne donne par ailleurs aucune information sur la structure des matériaux à l’échelle microscopique et macroscopique. A l’échelle microscopique, la matière se présente sous forme de cristaux (qu’on appelle microlites ou phénocristaux en fonction de leur taille) ou à l’état amorphe. La roche est dite microlitique lorsqu’elle est composée de microlites noyés dans une pâte amorphe (on dit aussi vitreuse). Elle peut également contenir des sphérolites, petites sphères composées d’aiguilles cristallines concentriques. Elle est grenue lorsqu’elle est composée de grains visibles à l’œil nu (phénocristaux) et microgrenue lorsque les grains ont une taille inférieure au mm. Lorsque les cristaux sont imbriqués entre eux, on parle de structure granoblastique. Lorsqu’ils sont broyés, on dit que la structure est cataclastique.
A une échelle plus grande, la matière présente une organisation caractéristique de son mode de formation. Les géologues ont classé ces différents types de roches en trois grandes familles :
les roches magmatiques formées par le refroidissement du magma,
les roches sédimentaires qui résultent de l'accumulation de sédiments,
les roches métamorphiques issues de la transformation de roches du fait de modifications des paramètres physico-chimiques du milieu dans lequel elles se trouvent (comme lors des processus d’orogénèse par exemple).
Parmi les roches magmatiques on distingue les roches effusives (ou volcaniques) et les roches plutoniques qui se sont formées dans les profondeurs de la Terre. On trouve les roches effusives au fond des océans ou dans les reliefs volcaniques récents à l'échelle géologique.

Roches effusives
Le basalte est une roche magmatique effusive. Le basalte est issu du refroidissement rapide d’un épanchement de magma. Il est composé de feldspath plagioclase, de pyroxène, d'olivine et d'une faible teneur en magnétite (voir le glossaire pus bas). Ces minéraux forment des microlites noyés dans une pâte vitreuse. Dans les rhyolites le feldspath est plutôt de nature alcaline. Les andésites sont des roches volcaniques dont la structure est également microlitique. Les andésites sont riches en feldspaths plagioclases et en hornblende.
Roches plutoniques
Le granite est la principale et la plus abondante des roches plutoniques. Le granite est une roche à texture grenue, riche en quartz et en feldspath alcalin. Il comporte également des inclusions de micas. Le granite est le résultat du refroidissement et de la cristallisation lente de grandes masses de magma situées en profondeur. C’est l’érosion ou l’orogénèse qui amène ensuite le granite en surface. Le granite peut contenir également de la hornblende, de la magnétite, du zircon (silicate de zirconium ZrSiO4) et de l'apatite (phosphate de calcium). Le gabbro est une roche plutonique à gros grain très pauvre en quartz. La diorite quant à elle a une teneur forte en feldspath plagioclase, en amphibole et en mica.
Roches sédimentaires
Les roches sédimentaires sont de natures diverses. On y trouve des grès, des schistes, des argiles, des marnes (argiles calcaires) ainsi que des roches carbonatées. Les grès sont le résultat de l’agrégation de grains de taille sableuse. Les schistes sont des roches qui se présentent sous forme de feuillets. Les schistes sédimentaires sont le plus souvent le résultat de la sédimentation d’argiles.
Les roches carbonatées sont essentiellement des carbonates de calcium (CaCO3) et de magnésium (MgCO3). La dolomie (présente dans la chaîne des Dolomites) est un carbonate de calcium et de magnésium CaMg(CO3)2.
Roches métamorphiques
Il existe une grande diversité de roches métamorphiques en fonction du type de roches ayant subi la transformation métamorphique : grès, argile, schiste, granite, basalte... L’ardoise par exemple est un schiste métamorphique. Le marbre quant à lui se forme par transformation métamorphique du calcaire. Le gneiss est une famille de roches métamorphiques qui regroupe des roches riches en quartz, en mica et en feldspath plagioclase sous forme de gros grains identifiables à l’œil nu. Les roches métamorphiques présentent toutes une structure en couches superposées (foliation) mais qui ne sont pas nécessairement facilement séparables.
Pour en savoir plus :
post sur la Terre
post sur les volcans
post sur la cohésion de la matière
post sur les cristaux
post sur les cristaux (suite)
post sur des exemples de cristaux
post sur les roches sédimentaires
post sur les roches magmatiques
post sur les roches métamorphiques
post sur les silicates
post sur les silicates haute pression dans le manteau terrestre
post sur les carbonates
post sur l’aluminium
post sur le fer
post sur le calcium
post sur le magnésium
post sur l’argile
glossaire de chimie minérale
index
#géologie#terre#roche#roche plutonique#roche magmatique#roche sédimentaire#roche métamorphique#phyllosilicate#aluminosilicate#inosilicate#nésosilicate#olivine#feldspath#granite#pyroxène#amphibole#mica#chimie#orogénèse#basalte#zircon#ardoise#argile#schiste#gneiss#gabbro#andésite#rhyolite#microlite#phénocristaux
1 note
·
View note
Text
Les roches sédimentaires
Les roches sédimentaires proviennent de la transformation en roches compactes de particules ou de grains qui se sont accumulés au cours du temps (les sédiments). Elles forment des couches (strates) qui sont nettement visibles lorsque des mouvements de terrain mettent à nu des failles dans le relief.
Nota : les particules ou grains que l’on retrouve dans les roches sédimentaires sont appelés des clastes.
Lorsque les matériaux qui forment les couches sédimentaires proviennent de l’érosion, on parle de sédiments terrigènes. S’ils consistent en fragments de coquilles qui s’accumulent au fond de l’eau, on parle de sédiments allochimiques. S’ils proviennent de la précipitation de minéraux présents dans un bassin marin ou lacustre on parle de sédiments orthochimiques. Les matériaux composant les sédiments terrigènes sont majoritairement des silicates ou des aluminosilicates. Dans le cas des allochimiques on trouve exclusivement des calcaires. Dans le cas des orthochimiques on trouve principalement des carbonates et en particulier des carbonates de calcium, mais aussi d’autres types de sels minéraux ou des nodules siliceux prisonniers d’une gangue calcaire.
La sédimentation terrigène se fait en quatre étapes :
l’altération superficielle des roches qui produit des particules,
le transport de ces particules par le vent ou l’eau vers un bassin de sédimentation,
la sédimentation proprement dite qui fait que les particules se déposent pour former une couche sédimentaire,
la diagénèse qui transforment les sédiments en roche sédimentaire.
Les deux autres formes de sédimentation ne nécessitent pas d’altération superficielle et pas nécessairement de transport. Au fond du bassin sédimentaire on peut retrouver les trois types de matériau qui se mélangent.
L’altération superficielle peut prendre différentes formes : mécanique (gel/dégel de l’eau, action des racines qui ouvrent des fractures, rabotage dû à la la progression des glaciers), chimique (les feldspaths sont facilement attaqués par l’eau de pluie, surtout si elle est acide), biologique (les lichens se nourrissent de sels minéraux). C’est l’eau qui assure ensuite le transport le plus efficace des particules (ruissellement, lessivage). Puis les particules se déposent au fond d’un bassin (lacustre ou marin) où ils forment des couches dont la nature peut varier avec le temps (stratification).
Le terme diagénèse est un terme générique qui englobe tous les processus mécaniques ou chimiques qui transforment les couches sédimentaires en roches. On peut classer de manière schématique les processus diagénétiques en deux catégories : les processus de cimentation précompaction et les processus de compaction.
Le processus de cimentation précompaction est simple. A l’origine, les particules sédimentaires ne sont pas jointives. De l’eau circule entre elles. Si cette eau est sursaturée en minéraux, ces minéraux précipitent et soudent les grains entre eux. Si par exemple les particules initiales étaient des grains de sable, on obtient du grès.
Le processus de cimentation par compaction est quant à lui mécanique. La pression élevée due au poids des couches sédimentaires supérieures s’exerce aux points de contacts entre les grains et entraine une dissolution locale de la matière (du quartz par exemple). Il y a alors sursaturation en silice du fluide qui remplit les espaces intercalaires. La précipitation des minéraux cimente une nouvelle fois les grains entre eux. Ces deux types de processus peuvent coexister et se compléter ou se succéder (avec, le cas échéant, des phases de redissolution).
Classification
Lorsque l’on a affaire à des sédiments majoritairement terrigènes, on donne aux roches sédimentaires un nom différent en fonction de la taille des grains. S’ils sont plus grands que 2 mm (graviers) on parle de conglomérat. Inférieurs à 2 mm et plus grands que 0,062 mm (sable) il s’agit de grès. En-deçà (boue) on parle de mudstone. Dans le cas de sédiments allochimiques, on prend une nouvelle fois en compte la taille des débris calcaires et on parle de calcirudite, de calcarénite ou de calcilutite. Pour les sédiments orthochimiques, seule la composition compte.
Quelques exemples
Il existe de très nombreux types de grès que l’on caractérise en fonction de leur ciment (la gangue dans laquelle sont pris les grains qui sont, eux, généralement sableux. On parle de grès siliceux lorsque le ciment est majoritairement composé de silice. Les quartzites, le grés de Fontainebleau ou le grès armoricain en sont des exemples. Le Menez-Hom ainsi que les roches de Plougastel sont des grès siliceux. Dans le cas du poudingue, le ciment est calcaire. La chaille est composée de concrétions siliceuses au sein d’une matrice calcaire. Il existe aussi des grès argileux, ferrugineux, phosphatés...
Les calcaires et la dolomie sont des roches détritiques carbonatées. Les calcaires sont majoritairement composés de carbonate de calcium CaCO3. Lorsque la proportion de carbonate de magnésium est du même ordre de grandeur on parle de dolomie (CaMg(CO3)2). Le karst est une structure géologique formée de roches calcaires ou dolomitiques façonnées par l’érosion, en particulier hydraulique (les roches carbonatées sont solubles dans l’eau).
Le gypse est quant à lui formé de sulfate de calcium hydraté CaSO4.H20.
Pour en savoir plus :
post sur la Terre
post sur la cohésion de la matière solide
post sur les cristaux
post sur les cristaux (suite)
post sur des exemples de cristaux
post sur les silicates
post sur les carbonates
post sur l’aluminium
post sur le calcium
post sur le magnésium
post sur l’argile
post sur les sels
post sur la géologie de la croûte terrestre
post sur les roches magmatiques
post sur les roches métamorphiques
post sur la terre
glossaire de chimie minérale
index
#chimie#géologie#sédiment#sédimentaire#feldspath#calcite#calcaire#argile#grès#mudstone#calcium#magnésium#sel#diagénèse
1 note
·
View note
Text
Une refonte complète de ce post sur l’ADN et les gènes…
Gènes et ADN
La génétique est la branche de la biologie qui s’intéresse aux gènes et à l’hérédité. De nos jours la génétique est principalement centrée sur l’étude de l’ADN (acide désoxyribonucléique) et de l’ARN (acide ribonucléique), son rôle dans le fonctionnement des cellules et dans l’expression des traits héréditaires (les phénotypes) et sa réplication.
L’ADN a été isolé pour la première fois en 1869 par un biologiste suisse, Friedrich Miescher. A la même époque, Gregor Mendel énonçait les règles de l’hérédité mais on ne fit pas tout de suite le lien entre ADN et hérédité. C’est à la fin du XIXème siècle qu’on découvre les chromosomes et leur rôle dans la transmission de l’hérédité. La théorie chromosomique de l’hérédité est proposée en 1902 par Walter Sutton. Il montre qu’elle est compatible avec les règles énoncées par Mendel et prédit l’existence de facteurs biologiques de l’hérédité. Les termes de gènes, génotype et phénotype apparaissent peu de temps après dans la littérature scientifique. Thomas Morgan démontre en 1911 que les chromosomes sont les supports des gènes que la théorie de Sutton prédisait. Il publie en 1913 la carte génétique du chromosome X de la mouche du vinaigre (dont le nom scientifique est drosophile).
L’analyse plus précise du rôle et de la structure des chromosomes et la mise en évidence du rôle central joué par l’ADN est le fruit de longues années de recherche. C’est en 1944 qu’ Oswald Avery, Colin MacLeod, et Maclyn McCarty démontrent le rôle de l’ADN comme support de l’hérédité. La structure en double hélice de l’ADN est découverte en 1953 par Francis Crick et James Watson et en 1955 on découvre l’ARN polymérase, une enzyme qui permet la réplication de l’ADN.
Dans les années 1960, les travaux de François Jacob et Jacques Monod permettent de mieux comprendre le séquencement des gènes dans l’ADN et établissent la différence entre gènes structuraux et gènes régulateurs. La notion de code génétique commence à se diffuser dans la communauté scientifique.
Les premiers travaux de manipulation génétique datent des années 1980 mais ce n’est qu’à la fin du XXème siècle que la technologie permet la cartographie du génome humain : cartographie d’un chromosome en 1999 et séquençage complet en 2003. La technologie permet aujourd’hui le séquençage d’une molécule d’ADN en quelques heures seulement.
ADN et ARN
L’ADN et l’ARN sont des chaînes polymères constituées de nucléotides chaînés entre eux. Un nucléotide est une molécule composée d’un pentose (désoxyribose C5H10O4 ou ribose C5H10O5), d’une base nucléique (aussi appelée base azotée) et de un à trois groupes phosphate. Un ribose est un pentose du type aldose (voir le post sur les sucres). Un désoxyribose est dérivé d’un ribose par perte d’un atome d’oxygène. Les nucléotides sont reliés entre eux par des liaisons phosphodiester.

Nota : Dans une liaison phosphodiester, le groupe phosphate entretient deux liaisons covalentes avec les atomes de carbone de deux nucléotides : R-O-(PO2)-O-CH2-R’. Dans le groupe central, le nombre d’oxydation de l’atome de phosphore est de 5 : une liaison double avec un atome d’oxygène et trois liaisons simples. Rappelons que la liaison ester passe par un atome d’oxygène qui est relié à un élément déjà porteur d’une liaison double avec un autre atome d’oxygène : R-(X=O)-O-R’.
Il y a cinq type de bases azotées : l’adénine (A), la guanine (G), la cytosine (C), la thymine (T, uniquement présente dans l’ADN) et l’uracile (U, uniquement présente dans l’ARN). L’adénine et la guanine sont des pyrines, la cytosine, la thymine et l’uracile sont des pyrimidines. Une base azotée est une molécule organique maillée dont certains nœuds sont constitués par des atomes d’azote (hétérocycles). Les bases azotées dérivent toutes de deux molécules qui présentent de nombreux isomères : la purine (C5H5N4) et la pyrimidine (C4H4N2). Ce type de molécule est une base au sens chimique du terme. Les bases azotées peuvent s’apparier entre elles par le biais de deux liaisons hydrogène (une pyrine avec une pyrimidine) car les atomes d’azote dispose d’un doublet non liant.

Structure des molécules d’ADN
Les molécules d’ADN ont une structure très particulière. Elles sont composées de deux chaînes polymères reliées entre elles par des ponts hydrogène entre bases azotées complémentaires.

Ceci confère aux molécules d’ADN une structure dite en double hélice très caractéristique.

ADN et cellules eucaryotes
On appelle cellules eucaryotes les cellules comportant un noyau. Les cellules des végétaux et des animaux sont des cellules eucaryotes. Celles des bactéries et des archées sont dites procaryotes : elles ne comportent pas de noyau et leur ADN est libre dans le cytoplasme. Dans une cellule, il y a deux types de cellules d’ADN : celles qui se trouvent au sein du noyau et celles qui sont portées par des organites, des sortes de microcellules comprises à l’intérieur du cytoplasme et qui jouent un rôle particulier dans le fonctionnement de la cellule. Dans les cellules animales, les mitochondries sont porteuses d’ADN. Dans les cellules végétales, ce sont les chloroplastes qui sont porteuses de molécules d’ADN hors noyau.
A l’intérieur du noyau, l’ADN est « empaqueté » dans une structure plus globale, la chromatine, qui comportent également des molécules d’ARN et deux types de protéines, les histones et les non-histones. L’empaquetage de l’ADN est plus ou moins condensé, ce qui joue un rôle sur l’expression des gènes (voir plus bas).
Lors des phases de division cellulaire, l’ADN s’organise de manière plus structurée. Les brins d’ADN se répartissent pour former des chromosomes. Cette répartition est caractéristique d’une espèce. Chez l’homme, on dénombre 46 chromosomes : 22 paires de chromosomes homologues et une paire de chromosomes sexuels (XX pour les femmes, XY pour les hommes). Le lion n’en a que 38, l’oignon 16 et la mouche 12. Par contre, le gorille en a 48, l’ananas 50, la vache 60 et le poulet 78 !
Chromosomes
Un chromosome est composé d’une molécule d’ADN et de protéines, histones et non-histones. Chaque chromosome a une structure bien précise. Il est constitué d’une succession de séquences d’ADN codantes et non codantes. Les séquences codantes sont situées à des endroits précis, appelés loci (pluriel de locus). Ces séquences constituent ce que l’on appelle des gènes. Un gène est une séquence d’ADN capable de synthétiser une cellule d’ARN messager sous l’effet d’une enzyme appelée ARN polymérase. Ces ARN messagers vont sortir du noyau et seront captés par les ribosomes, des structures complexes qui sont capables de « décoder » l’information contenue dans les ARN messagers pour synthétiser des protéines. Une protéine est un polymère composé de 100 à 1000 acides aminés. Elles sont capables d’activer des fonctions spécifiques au gène considéré (le phénotype).
Nota : le phénotype est la manifestation d’un trait génétique. Ce sont les protéines synthétisées par l’ARN messager sont le support des phénotypes.
Les gènes sont des séquences de codons. Un codon est constitué de trois nucléotides. Les codons sont, en quelque sorte, des mots de trois lettres, lettres qui sont prises dans un alphabet qui ne comporte que 4 signes différents A, C, G, U. Il y a donc 64 possibilités différents (43). C’est suffisant pour coder les 22 acides aminés protéinogènes qui rentrent dans la composition des protéines. Il est remarquable que ce codage soit le même pour toutes les espèces vivantes, qu’elles soient animales ou végétales !
Reproduction sexuée
Lors de la reproduction sexuée, les paires de chromosomes « parentes » se dissocient. Il se forme alors une nouvelle cellule au sein de laquelle chaque nouvelle paire de chromosomes est constituée d’un chromosome paternel et d’un chromosome maternel. (Si l’on fait exception de la paire de chromosomes sexuels, les paires qui s’assemblent sont des paires homologues – même structure en termes de loci.) Ainsi, pour chaque locus, on trouvera sur l’un des chromosome un gène transmis par le père et sur l’autre un gène transmis par la mère. On dit d’eux que ce sont des allèles (deux manières différentes de satisfaire à la même fonction). Dans certains cas, les allèles peuvent s’exprimer simultanément et produire un effet combiné (la couleur de peau par exemple). Dans d’autres un allèle ne peut s’exprimer que lorsque l’autre allèle produit un effet similaire. On dit alors qu’il est récessif. C’est la base des règles d’hérédité énoncées par Georges Mandel.
Remarque : lors de la reproduction, seul l’ADN du noyau porte des chromosomes paternels et maternels. Comme le noyau nouvellement formé est hébergé dans une cellule maternelle, l’ADN mitochondrial est exclusivement maternel.
Répression de l’expression des gènes
L’expression des gènes n’est pas automatique. Il existe des mécanismes de régulation ou d’inhibition, qui passent en général par des réactions de méthylation des nucléotides ou d’acétylation des histones qui composent la chromatine. Ces réactions de substitution inhibent l’action de l’ARN polymérase. La condensation de la chromatine peut jouer le même rôle en empêchant l’accès aux sites porteurs des gènes. Ces modifications peuvent être transmises d’une génération à l’autre sans pour autant affecter l’ADN. Elles sont héritables mais pas héréditaires. Cette branche de la biologie en plein développement s’appelle l’épigénétique.
L’ADN humain
L’ADN humains comporte 3,3 milliards de paires de bases et comprend approximativement 22000 gènes. Lors de la division cellulaire, il se répartit entre 23 paires de chromosomes : 22 paires homologues (chromosomes autosomes) et une paire de chromosomes sexuels (gonosomes).
Le corps humain est capable de synthétiser 12 des 22 acides aminés protéinogènes qu'il utilise, Neuf d'entre eux, dits acides aminés essentiels, doivent lui être apportés par l'alimentation.
Pour en savoir plus :
post d’introduction à la chimie du vivant
post sur les éléments chimiques
post sur les molécules des organismes vivants
post sur l’abondance des éléments dans le corps humain
post sur les glucoses
post sur les bases azotées
glossaire de chimie organique
index
#biologie#génétique#émigénétique#adn#arn#chromosome#mitochondrie#chromatine#protéine#mandel#acide aminé#gène#codon#hérédité#allèle#phénotype#eucaryote#procaryote#base azotée#ribose#désoxyribose
2 notes
·
View notes
Text
Les NOx, polluants primaires
On appelle NOx les oxydes d’azote, principalement le monoxyde d’azote NO, le dioxyde d’azote NO2 et protoxyde d’azote N2O. Les dégagements de NO et de NO2 proviennent principalement de la combustion des hydrocarbures ainsi que, dans une moindre mesure, de la combustion de la biomasse. La principale source de protoxyde d’azote est l’agriculture.
Les NOx sont considérés comme des polluants primaires. Ils font l’objet d’un suivi régulier et de normes de plus en plus restrictives. A ce jour, le taux de NOx ne prend en compte que le monoxyde d’azote et le dioxyde d’azote. Il est exprimé en « équivalent NO2 ».
Le dioxyde d’azote NO2 est un gaz toxique mortel. Le NO est également toxique à forte dose. A plus faible dose c’est un gaz irritant qui réduit la capacité d’oxygénation du sang et favorise l’asthme ou les bronchiolites.
Le NO2 est aujourd’hui le principal responsable des pluies acides (il se dissout dans l’eau pour donner de l’acide nitrique HNO3).
Les NOx sont des produits précurseurs de la pollution photochimique. Dans la haute atmosphère, les NOx réagissent avec l’ozone, le monoxyde de carbone CO et les composés organiques volatils (les COV dont fait partie le méthane) sous l’effet des rayons ultraviolets. Le résultat de cette réaction photochimique conduit à la production d’ozone, d’aldéhydes, de peroxyde d’hydrogène et de PAN CH3-C(=O)-OO-NO2 (nitrates de peroxyacétyle). Le PAN est un ester nitrique de l’acide peroxyacétique CH3-C(=O)-O-OH. L’acide peroxyacétique peut être produit directement à partir d’éthène C2H4 ou à partir d’acide acétique CH3-C(=O)OH :

Il est ensuite estérifié par l’acide nitrique formé par le dioxyde d’azote dissout dans l’eau. Tous ces produits sont des oxydants photochimiques. Ils contribuent à former un smog photochimique au moment des “pics d’ozone”. Outre le fait que ce smog contribue à l’effet de serre, il est également nocif pour la santé (irritation des voies respiratoires et des yeux, asthme, affections respiratoires…). Les PAN sont par ailleurs classés parmi les produits mutagènes et le peroxyde d’hydrogène H2O2 est un produit connu pour ses propriétés biocides.
Le protoxyde d’azote est un gaz à effet de serre puissant : sa contribution au réchauffement climatique est 300 fois plus élevée que le CO2 à masse égale.
Peut-on réduire les émissions de NOx ?
Les fabricants de moteurs diesel, principaux émetteurs de NOx, ont travaillé dans plusieurs directions pour réduire ces émissions. La première consiste à travailler sur la combustion, et en particulier sur l’injection, avec un effet réel mais limité. Une autre voie très active s’attaque aux gaz d’échappement. Renault par exemple a investi sur un système appelé Nox-trap. Qui a pour objectif de piéger les molécules d’oxyde. Les gaz d’échappement commencent par circuler dans le pot sur un catalyseur à base de platine qui transforme le monoxyde d’azote en dioxyde d’azote. Le dioxyde d’azote réagit ensuite sur de l’oxyde de baryum pour faire du nitrate de baryum Ba(NO3)2 qui reste piégé dans un dispositif spécifique. Le système doit être purgé régulièrement pour régénérer l’oxyde de baryum. D’autres constructeurs, comme Peugeot, travaille sur des dispositifs de type SCR (selective catalytic reduction). Le principe de ces dispositifs consiste à réduire les oxydes d’azote pour produire du diazote et de l’eau. On utilise pour cela le plus souvent de l’urée H2N-CO-NH2 :
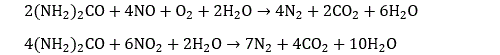
La réaction se produit à 950° sans catalyseur et à 300° avec catalyseur. D’autres dispositifs utilisent directement le pouvoir réducteur de l’ammoniac :
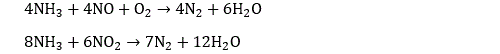
Ces dispositifs sont efficaces : 90% dans des conditions optimales pour le système SCR. Ce rendement descend à 70% dans les dispositifs existants. Le taux de réduction dépend en effet de la température du catalyseur et du mélange entre réducteur et oxydes d’azote. Ces dispositifs sont de plus très chers. En pratique, ils ne sont adaptés que pour des installations lourdes, des camions ou des véhicules de haut de gamme.
Pour en savoir plus :
post d’introduction à la chimie
post sur le dioxyde de carbone
post sur les acides et les bases
post sur l’oxydoréduction
post sur l’azote
post sur le moteur diesel
index
#chimie#azote#pan#cov#pollution#oxydant#photochimique#acide nitrique#polluant#gaz à effet de serre#smog#no2#n2o#co2#ammoniac#urée#émission#nox
0 notes
Text
Azote, bases azotées et chimie du vivant
Dans les deux posts précédents nous avons présenté les propriétés générales de l’azote et nous avons évoqué le rôle des groupes fonctionnels azotés en chimie organique. Nous avons également défini la notion d’alcaloïde. Nous allons maintenant nous intéresser aux bases azotées qui jouent un rôle essentiel dans la chimie du vivant. Les bases azotées sont des composants incontournables des nucléotides, les briques élémentaires de l’ADN.
Hétérocycles azotés et bases de Lewis
Un hétérocycle est une molécule organique cyclique dans laquelle un ou plusieurs atomes de carbone ont été remplacés par un autre atome. Un exemple : la pyridine C5H5N (aussi appelée azine) est un hétérocycle qui a une structure comparable à celle du benzène (cycle de 6 atomes). La pyridine sert de composant de base en pharmacie, dans l’industrie agroalimentaire, pour fabriquer des insecticides et des herbicides, ou encore comme arome ou comme colorant. L’atome d’azote qui remplace l’un des atomes de carbone entretient une liaison covalente avec les deux atomes voisins. Comme il n’est pas relié à un atome d’hydrogène, il reste trois électrons dans sa bande de valence : un électron non apparié et un doublet. L’électron non apparié contribue à la liaison pi délocalisée qui confère à la pyridine son caractère aromatique (voir le post sur les composés aromatiques). Le doublet restant est non liant, ce qui fait de la pyridine une base de Lewis et un ligand.
La pyrimidine C4H4N2 est également un hétérocycle aromatique à six atomes. Cette fois deux groupes CH sont remplacés par des atomes d’azote. C’est également une base de Lewis (même type de raisonnement que pour la pyrine).
L’imidazole C3H4N2 est un hétérocycle comportant dans son cycle trois atomes de carbone et deux atomes d’azote. L’un de ces atomes d’azote est porteur d’un atome d’hydrogène, l’autre non. Le premier de ces deux atomes entretient trois liaisons covalentes (deux avec ses voisins carbone, une avec l’atome d’hydrogène). Il lui reste un doublet qui occupe une orbitale pi. Le second n’entretient que deux liaisons covalentes (il ne porte pas d’atome d’hydrogène). Il lui reste un électron non apparié et un doublet. Les trois électrons des orbitales pi des atomes de carbone, le doublet du premier atome d’azote et l’électron non apparié du second forment une liaison pi délocalisée. L’imidazole est donc un composé aromatique (la règle de Hückel stipule que la liaison délocalisée doit comporter 6 électrons). L’imidazole dispose en outre d’un doublet non liant (celui du deuxième atome d’azote : c’est aussi une base de Lewis.
La purine C9H4N4 est un hétérocyclique aromatique composé d’une pyrimidine fusionnée à une imidazole. Comme l’imidazole et la pyrimidine elle comporte des doublets non liants qui en font une base de Lewis. La caféine C8H10N4O2, à titre d’exemple, est une purine. Dans la caféine, 3 des quatre atomes d’azote sont porteurs d’un groupe méthyle. Les deux atomes de carbone du groupe pyrimidine qui ne sont pas communs au groupe imidazole sont porteurs d’une double liaison avec un atome d’oxygène.
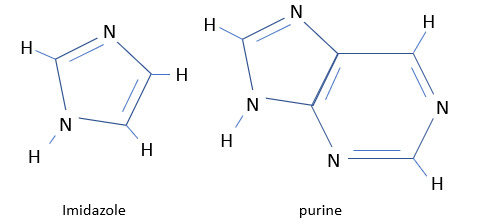
Bases nucléiques
La purine (C5H5N4) et la pyrimidine (C4H4N2) forment l’ossature des bases nucléiques (on dit aussi bases azotées) constitutives des nucléotides. Un nucléotide est une molécule organique qui associe un pentose, le ribose C5H10O5 ou le désoxyribose C5H10O4, une base azotée et de un à trois groupes phosphate. L'ADN (acide désoxyribonucléique) et l'ARN (acide ribonucléique) sont des polymères composés de chaînes de nucléotides.
L’ARN par exemple est un polymère constitué d’un enchaînement de monomères composés d’un ribose sous forme cyclique (ribofuranose) porteur d’une base azotée et d’un groupe phosphate.

La liaison polymère entre les nucléotides est une liaison phosphodiester sur le carbone 3 du pentose. Le désoxyribose C5H10O4 est obtenu par substitution de l’un des groupes hydroxyles -OH du ribose par un atome d’hydrogène. Le monomère de l’ADN (acide désoxyribonucléique) est construit de manière similaire à celui de l’ARN sur la base d’une molécule de désoxyribose cyclisée.

l y a 5 bases azotées dites canoniques : l'adénine (A), la cytosine (C), la guanine (G), la thymine (T) et l'uracile (U). L'ADN est formé à partir des bases A, C, T et G et l'ARN des bases A, C, G et U. Adénine et guanine sont des purines, cytosine, thymine et uracile des pyrimidines. Dans la double hélice de l'ADN, cytosine et guanine sont reliées par des ponts hydrogène ainsi qu'adénine et thymine (une purine avec une pyrimidine).

Les bases azotées sont porteuses de l’information génétique transmise par l’ADN. L’analyse de la chaîne de l’ADN montre qu’elle est composée d’une succession de gènes. Un gène est un ensemble constitué par plusieurs nucléotides. On peut donc le voir comme portant un code sur écrit avec une base quaternaire dont les « bits » sont A, C, T et G. L’ADN est une machine à synthétiser des protéines. L’information contenue dans un gène est recopiée dans une molécule d’ARN (ARN messager) et c’est cette molécule d’ARN qui sert de support à la synthèse d’une protéine. Une protéine est une macromolécule constituée d’une chaîne de molécules dérivées d’acides aminés.
Le couple ADP/ATP (adénosine di- et triphosphate) joue également un rôle essentiel dans la chimie du vivant (photosynthèse et respiration cellulaire). Ces deux molécules sont construites sur un modèle semblable à celui du monomère de l’ARN. La base azotée est dans ce cas une molécule d’adénosine C10H13N5O4. La molécule d’adénosine est une molécule d’adénine dont on a substitué l’un des atomes d’hydrogène par un cycle C4O (quatre atomes de carbone, un atome d’oxygène). Le groupe phosphate est remplacé par un groupe diphosphate dans le cas de l’ADP ou triphosphate dans le cas de l’ATP.

Le NAD et le NADP (nicotinamide adénine dinucléotide et le nicotinamide adénine dinucléotide phosphate) sont des coenzymes réductrices qui joue un rôle tout aussi important dans la photosynthèse et la respiration cellulaire. Elles sont formées (comme leur nom l’indique) à partir de deux nucléotides. Le premier nucléotide est porteur d’une base nucléique adénine. Le deuxième est un nicotinamide riboside, une molécule de ribofuranose porteuse d’un nicotinamide sur son carbone 1.

Le dinucléotide est obtenu par estérification du phosphate en bout de chaîne de l’ADP avec le groupe hydroxyle du carbone 5 du nicotinamide riboside.
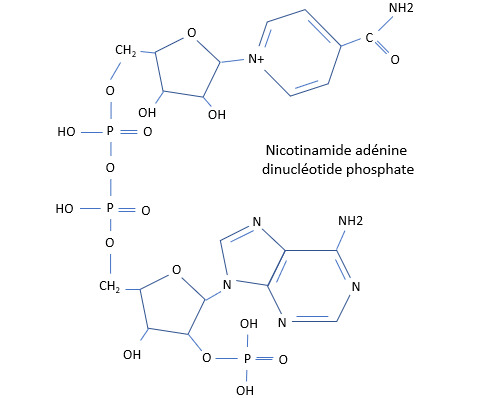
Pour plus d’information, n pourra consulter le post sur les couples ADP/ATP et NAD/NADH.
Le cycle de l’azote
Tout comme pour le carbone il existe un cycle de l’azote directement lié à la vie sur Terre. L’azote est présent dans les plantes et dans les animaux. Il se décompose dans le sol, soit en fin de cycle de vie des plantes et des animaux, soit après déjections par les animaux. La décomposition donne des ions ammonium (aussi appelé ammoniaque) qui se fixe dans le sol sous l’effet de bactéries. D’autres bactéries dites nitrifiantes transforme ces ions en nitrites et en nitrates. Ceux-ci sont absorbés par les plantes lors de leur croissance et la boucle est bouclée. Enfin pas tout à fait : une partie de ces nitrates sont absorbés par des bactéries dénitrifiantes qui libèrent du diazote qui rejoint l’atmosphère. Le diazote peut être fixé directement par certaines plantes mais c’est une exception.
L’abus d’engrais azotés conduit à l’eutrophisation des sols et de l’eau (excès de nutriments) et au développement de plantes et d’algues invasives (comme les algues vertes).
Assimilation de l'azote par les plantes
L'azote est indispensable au développement de la vie. Sans acides aminés et sans bases azotées, pas de nucléotides et pas de protéines. Les plantes sont autotrophes. La synthèse des acides aminés par les plantes passe par la production d’amides et d’amines. Or le diazote N2 abondant dans l'air n'est utilisable directement que par les cellules de certaines plantes (les légumineuses). Dans ce cas, l'azote atmosphérique est absorbé et réduit (au sens chimique du terme du terme) par les rhizobia, des bactéries qui agissent en symbiose avec les légumineuses qui leur apportent l'énergie nécessaire sous forme d'ATP.
Nota : on dit d'un organisme qu'il est autotrophe lorsqu'il est capable de produire de la matière organique par réduction de matière inorganique et minérale.
Pour ce qui est des nitrates présents dans le sol, ils doivent tout d’abord être transformés en ions ammonium NH4+. Ces ions ammonium peuvent être absorbés directement par les plantes sous forme d'ammoniac mais ce n'est pas un procédé très efficace. En effet, seul l'ammoniac à proximité des racines peut contribuer au développement des plantes. Au-delà d’une certaine distance les ions ammonium se fixent sur les minéraux du sol.
La transformation des ions nitrates NO3- absorbés par les racines des plantes en ions ammonium (une réaction de réduction) se fait en deux étapes. Elle nécessite l'action de deux enzymes (ainsi que de l'énergie sous forme d'ATP). La première étape réduit les nitrates en nitrites :

Elle se fait en dehors du chloroplaste. La seconde réduit les nitrites en ammonium à l'intérieur du chloroplaste :

L’assimilation de l’ammonium par les cellules se fait lui aussi par étapes, tout d'abord dans les chloroplastes (ou dans le foie et les reins pour les animaux) où l'ammonium est fixé sous forme de glutamine, un acide aminé alpha-cétonique de formule (NH2)C(=O)-(CH2)2-CH(NH2)-COOH. La glutamine est ensuite transportée dans les tissus où elle permet notamment la catalyse de la pyrine et de la pyrimidine, les bases nucléiques constitutives de l'ADN.
Les animaux et parmi eux les humains dépendent entièrement de l'azote qui provient de leur alimentation. On dit qu'ils sont hétérotrophes.
Pour en savoir plus :
post sur les propriétés générales de l’azote
post sur l’azote dans la chimie organique
post sur le carbone
post sur la classification périodique des éléments
post sur les acides et les bases
post sur les hydrocarbures aromatiques
post sur la photosynthèse
post sur les gènes et l’ADN
post sur les couples ADP/ATP et NAD/NADH
glossaire de chimie générale
glossaire de chimie organique
index
#chimie#azote#eutrophisation#purine#adénine#guanine#adn#arn#atp/adp#NADPH#cytosine#thymine#uracile#pyridine#pyrimidine#hétérocycle#aromatique#lewis#base de lewis
0 notes
Text
Azote et chimie organique
Dans le post précédent nous avons présenté les propriétés générales de l’azote. L’azote joue un rôle particulier en chimie organique (chimie des dérivés de chaînes carbonées) et nous allons nous pencher plus particulièrement sur ce volet de la chimie de l’azote. Nous commencerons par présenter les groupes fonctionnels azotés (nitro, nitrile, amine, amide...) avant de nous intéresser aux azines, aux hétérocycles azotés et aux alcaloïdes. Nous consacrerons par la suite un post spécifique aux bases azotées et au rôle de l’azote dans la chimie du vivant.
Groupe nitro et nitrile
Le groupe nitro est un groupe fonctionnel de formule -NO2. La substitution d’un atome d’hydrogène par un groupe nitro s’appelle la nitration. Le nitrométhane CH3NO2 en est l’exemple le plus simple. Le nitrométhane sert à la fois de solvant et de carburant. Le trinitrotoluène CH3-C6H2(NO2)3 aussi connu sous le nom de TNT est un explosif puissant.
Les nitrophénols forment une classe particulière des composés organiques azotés. Ils sont obtenus par substitution d’un ou plusieurs atomes d’hydrogène du phénol C6H5OH par un groupe nitro. Exemples : nitrophénol C6H4OH(NO2) ou dinitrophénol C6H3OH(NO2)2. Les nitrophénols sont très utilisés par l’industrie pour la synthèse de colorant, de pesticides, de fongicides ou d’explosifs.
On parle de groupe nitrile lorsqu’un atome d’azote est relié à une chaîne carbonée par une liaison triple. (Le groupe -CN, avec une liaison triple entre l’atome de carbone et l’atome d’azote, porte le nom de groupe cyano.) L’acétonitrile H3C-CN est un solvant pharmaceutique ou cosmétique. L’acrylonitrile H2C=CH-CN (aussi appelé cyanure de vinyle) est un produit de base de nombreux plastiques ou fibres synthétiques. Le benzonitrile C6H5-CN est un solvant. Le cyanoacétylène HC3N est carctérisé par deux liaisons triples, celle du groupe nitrile et une autre entre deux atomes de carbone (H-CC-CN). Le glycolonitrile HOCH2-CN est un dérivé du méthanol (cyano méthanol). C'est un composé organique précurseur de la glycine, un acide aminé protéinogène. En présence d'ammoniac, le glycolonitrile donne de l'aminoacetonitrile H2N-CH2-CN qui s'hydrolyse ensuite sous forme de glycine :

On a récemment trouvé des traces de glyconitrile dans le nuage de poussières qui entoure une protoétoile. On a également détecté des traces d’aminoacétonitrile dans les nuages interstellaires de la Voie Lactée.
Amine, acide aminé et groupe amide
Une amine est une molécule dérivée de l’ammoniac dans laquelle un ou plusieurs atomes d’hydrogène est (sont) substitué(s) par une chaîne carbonée : NH2R, NHR2, NR3. Le triméthylamine N(CH3)3 est l’amine la plus élémentaire. Lorsqu’un groupe -NH2 est relié à un atome de carbone dans une chaîne carbonée, on le qualifie de groupe amine (formule R-(C-NH2)-R’).
Nota : la lettre R symbolise ici une chaîne carbonée reliée à l’atome d’azote par un atome de carbone. Lorsqu’elle apparaît plusieurs fois dans la même formule, elle peut représenter différentes chaînes carbonées.
L’aniline C6H5NH2 est une phénylamine. La chaîne carbonée est dans ce cas un composé aromatique (en l’occurrence ici du benzène). L’aniline a de nombreuses applications, comme composant dans les teintures ou en pharmacie par exemple. Lorsque le groupe amine est la fonction principale du composé, son nom est caractérisé par le suffixe -amine. Lorsqu’il intervient comme fonction secondaire, il est caractérisé par le préfixe amino-. L’aminopropanoate C3H6NO2- par exemple est la base associée de l’acide aminopropanoïque.
Un acide aminé est un acide carboxylique possédant au moins un groupe fonctionnel amine (primaire -NH2 ou secondaire -NH-). Les acides aminés sont les molécules de base des protéines. Une protéine est une macromolécule constituée de résidus d’acides alpha-aminés (groupe amine sur le carbone alpha) liés entre eux par des liaisons peptidiques.

La glycine (NH2)H2C-COOH (acide aminoéthanoïque) et l'alanine (CH3)(NH2)HC-COOH (acide aminopropanoïque) sont des acides aminés très répandus. L’acide 2-amino-pentanedioïque HOOC-CH(NH2)-(CH2)2-COOH est un acide aminé protéinogène plus connu sous le nom d’acide glutamique. Le glutamate de sodium (GMS) est le sel sodique de l’acide glutamique. Il est utilisé comme additif alimentaire (E621). La glutamine (H2N)C(=O)-(CH2)2-CH(NH2)-COOH est l'acide aminé le plus abondant du sang.
La méthionine H3C-S-(CH2)2-(CHNH2)-COOH est un acide aminé protéinogène essentiel (qui ne peut pas être synthétisé par l’organisme). C’est un acide 2-amino-4-méthylsulfanylbutanoïque : un groupe amine sur le carbone 2 et un groupe méthylsulfanyl -S-CH3 sur le carbone 4 (donc en bout de chaîne).
Les acides aminés protéinogènes sont les molécules constitutives des protéines. Il en existe 22, dont 9 sont essentiels.
Une imine est un composé caractérisé par une double liaison carbone azote : RR’C=NR’’. Le butanimine CH3–CH2–CH2–CH=NH est une aldimine. Le mot aldimine est formé à partir du mot aldéhyde, le groupe =NH remplaçant le groupe =O.
Un amide est un composé dérivé d’un acide carboxylique dans lequel le groupe hydroxyle -OH est remplacé par un groupe -NR2 (formule semi-développée R-C(=O)NR2). Le formamide HC(=O)NH2 a de multiples usages dans l’industrie chimique. Des traces d’acétamide H3C-C(=O)NH2 ont été détectées sur la comète Tchoury par l’atterrisseur Philae. Les amides jouent un rôle important dans la chimie du vivant. Ils ont également d’autres propriétés utilisées dans l’industrie. En particulier, ils polymérisent facilement et donnent des polyamides. Le nylon et le rilsan sont des polyamides. Les sulfamidés R-(SO2)-NR’2 sont des agents antibactériens utilisés en pharmacie (l’atome de soufre central porte deux doubles liaisons avec les atomes d’oxygène en plus de ses liaisons simples avec le groupe amine et la chaîne carbonée R).

L’urée (ou carbamide) est un composé organique particulier. Sa formule développée est H2N-(C=O)-NH2. Le groupe central est composé d’un atome de carbone porteur d’une liaison double avec un atome d’oxygène relié à deux groupes amine. L’urée est produit dans le foie par dégradation des acides aminés. Il est utilisé da manière intensive comme engrais mais également dans la synthèse de matières plastiques. Son pouvoir réducteur des oxydes d’azote est utilisé pour réduire les émissions de NOx dans les moteurs diesel :

L’urée ne doit pas être confondue avec l’acide urique C5H4O3N4, un dérivée des purines (voir plus bas).
Groupes amines et composés organophophorés et organosulfurés
La substitution d’un groupe hydroxyle par un groupe -NR2 peut intervenir dans le cas de composés organophosphorés ou organosulfurés (voir les posts consacrés au phosphore et au soufre). Les sulfamidés (ou sulfonamides) de formule générique R(SO2)NR2 en sont un bon exemple. Ils sont à la base de nombreux médicaments antibiotiques. Les phosphoramidates sont des composés organophosphorés (ou simplement des phosphates) dans lesquels un groupe -OR est remplacé par un groupe -NR2. La phosphocréatine C4H10N3O5P est une molécule organique essentielle dans le processus de régénération de l'ATP dans les muscles (formule développée (HO)2(P=O)-NH-(C=NH)-(NCH3)-CH2-COOH).
Hydrazines, hydrazones et azines
Les hydrazines sont des composés organiques dérivés de l’hydrazine H2N-NH2 par substitution d’un ou plusieurs atome(s) d’hydrogène par une chaîne carbonée (alkyle, aryle…). Le diméthylhydrazine H2N-N(CH3)2 est utilisé comme ergol dans les moteurs de fusée (UDMH). La phénylhydrazine C6H8N2 est une molécule « tueuse » de globule rouge. Elle a pour formule développée C6H5-HN-NH2. Dans ce cas, l’un des atomes d’hydrogène de l’hydrazine a été remplacé par un groupe phényl. Le dinitrophénylhydrazine (O2N)2C6H3-HN-NH2 (abréviation DNPH) est utilisé en chimie pour détecter la présence d’aldéhyde.
Les hydrazones et les azines sont définis comme étant des composés obtenus par condensation de l’hydrazine avec un aldéhyde ou une cétone. Dans le cas des hydrazones, la condensation n’affecte qu’un groupe amine de l’hydrazine (RR’C=NNH2). C’est le cas par exemple du benzophénone hydrazone (formule (C6H5)2-C=N-NH2).

Dans le cas des azines, les deux groupes sont affectés (RR’C=N-N=CRR’). On parle d’aldazine ou de cétazine dès lors qu’on a affaire à un aldéhyde ou à une cétone. L’acétone azine (H3C)2C=N-N=C(CH3)2 est la plus simple des cétazines.
Hétérocycles
La phtalazine C8H6N2 est une azine particulière. Les chaînes de chaque côté du groupe central =N-N= se rebouclent pour former un hétérocycle. L’hydralazine C8H5N2-HN-NH2 (hydrazinophtalazine) est constitué d’une molécule de phtalazine qui porte un groupe hydrazine. C’est un médicament contre l’hypertension.

Remarque : le nom d’azine est également utilisé comme synonyme de pyridine.
Le pyrrole C4H5N (aussi appelé azole) est un composé aromatique hétérocyclique à cinq atomes dans lequel un groupe CH est remplacé par un groupe NH. Les pyrroles rentrent dans la composition de la chlorophylle. L’imidazole C3H4N2 est également un composé aromatique hétérocyclique à cinq atomes mais qui porte cette fois deux atomes d’azote (en position 1 et 3). C’est un diazole. L’un des atomes d’azote n’est pas relié à un atome d’hydrogène et il porte un doublet électronique non liant, ce qui confère à l’imidazole le caractère d’une base de Lewis. Il existe également des triazoles et des tétrazoles.

L'indole C8H6NH est constitué d'un cycle benzénique accolé à un pyrrole. On trouve la molécule d’indole dans l'indigo. Tout comme le pyrrole, ce n'est pas une base de Lewis. La sérotonine C10H12N2O est un dérivé de l'indole (une indolamine). Le cycle benzène de la sérotonine porte un groupe -OH et le cycle pyrrole un éthyloamine -CH2-CH2NH2. La formule semidéveloppée de la sérotonine s'écrit HO-C8H4NH-C2H4NH2. La sérotonine est un neurotransmetteur.
Alcaloïdes
Les alcaloïdes sont des composés organiques d’origine végétale à caractère alcalin (basique) contenant au moins un atome de carbone. Ils sont en général toxique à forte dose mais peuvent avoir des effets thérapeutiques ou excitants à plus faible dose. La caféine, la morphine, la nicotine, la strychnine ou la cocaïne sont des alcaloïdes. Les alcaloïdes sont souvent des chaînes hétérocycliques.
La nicotine C10H14N2 est un exemple d'alcaloïde. La nicotine est constituée d'une molécule de pyridine liée à une molécule de méthylpyrrolidine C4H8N-CH3 (l'atome d'azote de la pyrrolidine est porteur d'un groupe méthyl -CH3). La liaison entre les deux molécules se fait entre le carbone 3 de la pyridine et le carbone 2 du méthylpyrrolidine. On trouve la nicotine dans la feuille de tabac… mais aussi dans l’aubergine, la tomate ou le chou-fleur.
La caféine est aussi un alcaloïde, un triméthylxanthine C8H10N4O2. La xanthine C5H4N4O2 est une molécule comportant deux cycles adjacents, un cycle de six atomes et un cycle de cinq. Le cycle de six atomes porte deux groupes cétone -C(=O)-, un groupe -NH- et un atome d'azote qui possède un doublet non liant, ce qui confère à l'ensemble un caractère de ligand et de base de Lewis. On pourrait citer également la morphine C17H19NO3, extraite du pavot, une molécule polycyclique assez complexe.
Les alcaloïdes forment facilement des sels ou des N-oxydes. Les N-oxides, ou amines-oxydes, sont des molécules de formule générique R3N+-O- hautement polaires. Dans le cas des alcaloïdes et, plus généralement, des bases azotées (voir le post consacré aux bases azotées), l’atome d’azote n’entretient pas trois liaisons avec des atomes de carbone de trois chaîne organiques mais il engage trois électrons de valence dans les liaisons qu’il entretient avec la chaîne aromatique à laquelle il participe.
Lorsque les alcaloïdes sont des composés hétérocycliques, ils font partie de la classe des bases azotées. Une base azotée, ou base nucléique, est un composé organique hétérocyclique à caractère basique (au sens des bases de Lewis) comprenant au moins un atome d’azote. Les bases azotées et leur rôle dans la chimie du vivant seront abordés dans un post ultérieur.
Pour en savoir plus :
post sur les propriétés générales de l’azote
post sur l’azote dans la chimie du vivant
post sur le carbone
post sur la classification périodique des éléments
post sur les hydrocarbures aromatiques
post sur les acides et les bases
post sur les bases nucléiques
post sur l’acide carboxylique
post sur les glucides
post sur le phosphore
post sur le soufre
glossaire de chimie générale
glossaire de chimie organique
index
#chimie#azote#amine#acide aminé#nitrile#base de lewis#alcaloïde#hétérocycle#hydrazine#pyrrole#azine#nicotine#caféine
0 notes
Text
L’azote
L’azote est un élément chimique (symbole N) qui nous est familier et qui nous paraît bien inoffensif. En termes d’abondance, il pointe en 7ème position dans la voie lactée (0,1 %). S’il flirte avec la 30ème position dans la croûte terrestre (à égalité avec l’yttrium et le cobalt) il est très présent dans l’eau de mer et surtout dans l’atmosphère (78 %). Dans le corps humain, il arrive en 4ème position, avant le calcium, composant essentiel de notre squelette.
Ce qu’on sait moins, c’est que cet élément que nous inhalons à pleins poumons tous les jours peut être un redoutable poison lorsqu’il est associé à d’autres éléments : oxydes d’azote, cyanure, PAN...
Caractéristiques physicochimiques
L’azote est un élément de la deuxième rangée du tableau périodique des éléments. Son numéro atomique est 7. C’est un pnictogène, comme le phosphore, l’arsenic ou l’antimoine. Il existe une quinzaine d’isotopes de l’azote mais seuls deux sont stables, le 14N (plus de 99,5 % de la quantité totale d’azote sur Terre) et le 15N. Le 13N a une demi-vie de 10 minutes et les autres de moins de 10 secondes.
Dans les conditions normales de température et de pression, l’azote existe sous forme gazeuse. Sa température d’ébullition est de -195,8° C et sa température de fusion de -209,9° C. A l’état solide, sa structure cristalline est hexagonale. Son potentiel de première ionisation vaut 14,5 eV. Son électronégativité 3,04, elle est supérieure à celle de l’hydrogène et du carbone mais inférieure à celle de l’oxygène qui vaut 3,44.
L’azote possède 7 électrons (1s2, 2s2, 2p3). A l’image de tous les pnictogènes, il possède trois électrons sur sa sous-couche 2p. Sa valence est donc théoriquement égale à 3. Il existe cependant de nombreux composés dans lesquels le cation azote entretient quatre liaisons covalentes. C’est le cas par exemple dans l’ion nitronium [O=N=O]+, très instable, ou plus simplement dans l’acide nitrique et les ions nitrates.
Le degré d’oxydation de l’azote peut varier entre -3, comme dans l’ammoniac NH3, à +4 dans les nitrates.
L’azote peut entretenir des liaisons covalentes avec divers éléments. Les énergies de liaison relativement modérées de ces liaisons en font un élément assez réactif.

Les dérivés de l’azote
La chimie de l’azote est riche. Il est à la fois nucléophile et oxophile et il possède donc de nombreux dérivés.
Avec l’hydrogène, le composé le plus connu est l’ammoniac (NH3) et les ions dérivés (ammonium NH4+ et amidure NH2-). L’ammoniac est produit de manière industrielle et a de nombreuses applications : engrais, explosif, agent polymère, fluide réfrigérant. Les amines (formule générique RNH2 et R2NH) jouent un rôle important en chimie organique.
L’hydrazine N2H4 (aussi appelée diazane) a pour formule développée H2N-NH2. C’est un carburant utilisé dans les lanceurs et les piles à combustible. L’acide azothydrique ou azoture d’hydrogène HN3 est un acide faible.
Oxydes d’azote
Il existe plusieurs oxydes d’azote. Les plus connus sont le monoxyde d’azote NO et le dioxyde d’azote NO2 (que l’on qualifie de NOx et dont les effets polluants sont maintenant reconnus) mais on peut citer également l’azoture de nitrosyle N4O, le protoxyde d’azote N2O (aussi appelé gaz hilarant et utilisé comme anesthésiant), le trioxyde d’azote N2O3, le peroxyde d’azote N2O4, un dimère du dioxyde d’azote, et le pentaoxyde d’azote N2O5. Dans la molécule de dioxyde d’azote, l’atome d’azote entretient une liaison covalente simple avec chaque atome d’oxygène. IL possède donc un électron non apparié sur sa couche externe. Le NO2 a toutes les caractéristiques d’un radical libre. Il est de fait très réactif, en particulier avec les molécules organiques. Dans la nature, il est en équilibre avec son dimère, le peroxyde d’azote N2O4.
Dissous dans l’eau, le monoxyde d’azote et le dioxyde d’azote donnent respectivement de l’acide nitreux HNO2 et de l’acide nitrique HNO3. Les anions libérés par ces acides sont l’ion nitrite NO2- et l’ion nitrate NO3- et sont à la base de nombreux sels. L’ion nitrate est un oxydant puissant qui s’attaque au cuivre, au zinc et même à l’argent.

Remarque : dans le schéma ci-dessus de l’acide nitrique, on a représenté l’ion azote avec une liaison double N=O et une liaison simple N-O. En fait, pour des raisons de symétrie, il n’y a pas localisation de la liaison double. Elle est partagée entre les atomes d’oxygène qui, pour la même raison, se partagent la charge électrique négative.
L’azote peut être oxydé par les halogènes mais les halogénures d’azote sont généralement instables si l’on fait exception du trifluorure d’azote NF3.
Le cyanure CN- est l’anion libéré par l’acide cyanhydrique HCN en solution. Il est caractérisé par une liaison triple entre le carbone et l’azote.
Ions et sels azotés
Les azotures sont les sels formés par l’acide azothydrique. La formule détaillée de l’ion azoture est N-=N+=N-. L’ion azoture est un oxydant très corrosif, en particulier avec les métaux. L’azoture de sodium NaN3 est utilisé pour gonfler très rapidement les airbags (décomposition en sodium et en diazote).
En chimie organique les azotures d’acyle sont des dérivés d’acide carboxylique de formule générique RCON3. Les azoture d’alkyle sont des dérivés des alcanes de formule RCN3. L’azoture de méthyle H3CN3 est un explosif.
Les nitrures sont les sels formés à partir de l’ion nitrure N3-. Il existe de nombreux nitrures métalliques, comme le nitrure d’aluminium AlN. La nitruration est un procédé très utilisé en métallurgie (traitement de surface).
L’ion amidure NH2- est la base conjuguée de l’ammoniac.
Les nitrites sont formés avec l’ion nitrite NO2-.
Les nitrates sont les sels formés avec l’ion nitrate NO3-.
L’ion nitrate a, comme l’acide nitrique, une configuration particulière. Il est constitué par un cation N+ entouré par trois anions O(-) porteurs d’une charge partielle. Le cation N+ est tétravalent et on peut supposer que ses orbitales sont hybridées sp2. A partir de là, on peut imaginer qu’il entretient une double liaison avec un atome d’oxygène et deux liaisons simples avec des ions O- qui possèdent tous deux un électron célibataire. Mais la nature déteste les dissymétries, particulièrement au niveau quantique. La double liaison N=O va se délocaliser sur les trois atomes d’oxygène, tout comme la charge. Cela fait de l’ion nitrate un ion très stable. Les sels de nitrate sot facilement solubles dans l’eau, la charge de l’ion étant répartie sur toute sa « surface ».

Esters
L’azote peut intervenir dans des esters de l’acide nitrique. Ces esters portent également le nom de nitrates :

Dans le cas d’un alcool primaire, le composé obtenu est un nitrate d’alkyle (nitrate de méthyle H3C(ONO2), nitrate d’éthyle C2H5(ONO2)…). Les nitrates d’alkyle ont souvent des propriétés explosives lorsqu’ils sont chauffés. La dissociation thermique de la molécule de nitrate produit du dioxyde de carbone et du diazote. C’est la libération de l’énergie de la triple liaison covalente entre les atomes qui constituent le diazote qui produit la détonation. L’exemple le plus typique est celui de la nitroglycérine CH2(ONO2)-CH(ONO2)-CH2(ONO2).

Le nitrate de peroxyacétyle CH3-C(=O)-OO-NO2 (ou peroxyacétyl nitrate, PAN) est une ester de l’acide peroxyacétique CH3-C(=O)-O-OH et de l’acide nitrique. C’est un polluant photochimique responsable de difficultés respiratoires graves.
Les nitrites d’alkyles sont des esters d’alkyle de l’acide nitreux HNO2. Leur formule est RON=O. Le nitrite d’amyle C5H11NO2 (dont la formule développée est (CH3)2CH-CH2-CH2ON=O) est un ester de l’alcool amylique C5H11OH (méthylbutanol) et de l’acide nitreux. C’est un vasodilatateur utilisé en pharmacie.
Base de Lewis et ligand
De par sa configuration électronique, l’azote a des capacités complexantes. L’ammoniac NH3 est une base de Lewis. L’ammoniac et les amines sont des ligands qui interviennent dans de nombreux complexes, comme l’hexaammino cobalt [Co(NH3)6]3+. L’ion NO2- est lui aussi un ligand. On le trouve par exemple dans le sel rouge de Roussin K2[Fe2S2(NO)4]. Le nitritopentaammino cobalt (formule [Co(NH3)5(ONO)]2+) combine ligand ammino et nitrito ONO-. Dans le cas du ligand nitrito, la liaison de coordination est portée par un atome d’oxygène et non par l’atome d’azote. C’est également le cas pour le ligand cyano CN- : c’est l’atome de carbone qui porte la liaison de coordination (tétracyanocuprate [Cr(CN)4]2-). Pour plus de détails, on se reportera au post sur les complexes.
Le rôle de l'azote en chimie organique est détaillé dans un post ultérieur.
Pour en savoir plus :
post d’introduction à la chimie du vivant
post sur les éléments chimiques
post sur la classification périodique des éléments
post sur l’abondance des éléments dans le corps humain
post sur l’azote dans la chimie organique
post sur l’azote dans la chimie du vivant
post sur les acides et les bases
post sur les éléments nucléophiles
post sur les complexes et les ligands
post sur l’acide carboxylique
post sur les NOx
post sur les métaux alcalins
glossaire de chimie générale
glossaire de chimie organique
index
#chimie#azote#ammoniac#nitrate#nitrite#nitrure#azoture#adn#arn#acide aminé#protéine#acide carboxylique#amine#amidure#acide nitrique#acide azothydrique#nox
0 notes