Text
Les métaux de transition
Les métaux de transition sont les éléments du bloc d du tableau de classification périodique de Mendeleïev. Les éléments de cette famille sont ceux dont la bande de valence présente une couche d incomplètement remplie. Cette famille inclut les éléments dont la bande de valence a la configuration suivante :
4s2, 3dx
5s2, 4dx
6s2, 4f14, 5dx
x étant inférieur ou égal à 10. Les éléments de la rangée 7 sont exclus de la famille (ils sont classés dans celle des transactinides). Le lanthane La, premier élément de la rangée 6, est attribué quant à lui à la famille des lanthanides. Le zinc Zn, le cadmium Cd et le mercure Hg, qui font partie du bloc d, ne sont pas des métaux de transition puisque leur sous-couche d est complète. Ils ont d’ailleurs des caractéristiques différentes. Leur température de fusion en particulier est beaucoup plus basse que celle des autres éléments du bloc d : le mercure est liquide à température ambiante ! On les classe dans la famille des métaux pauvres. La famille des métaux de transition comporte 26 éléments. On notera que, parmi ces éléments, le technétium Tc est radioactif (Le 99Tc a une demi-vie de 4,2 millions d’année).
Remarque : certains métaux de transition peuvent avoir une configuration du type ns1, (n-1)dx.
Liaison métallique
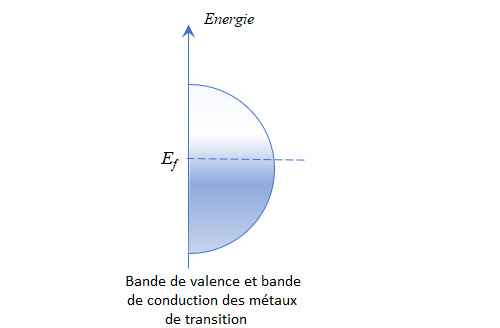
L’une des spécificités de ces éléments tient à leur propension à former des cristaux au sein desquels ils sont reliés par une liaison appelée liaison métallique. La liaison métallique est assurée par un nuage électronique délocalisé qui s’étend à tout le cristal (on parle de fluide d’électrons). La géométrie des orbitales de la couche d et le fait qu’elle ne soit pas remplie permet ce type de liaison entre cations métalliques, liaison qui se propage du fait des symétries du cristal. Le principe d’exclusion de Pauli implique cependant une différenciation entre les niveaux d’énergie des électrons de ce nuage délocalisé. Du fait du nombre considérable d’électrons de valence au sein d’un seul cristal, cela conduit à une multitude de niveaux espacés d’un écart infinitésimal. On se retrouve au final avec une bande d’énergie qu’on peut assimiler à un continuum.
Une autre caractéristique de ces éléments est que la bande de valence et la bande de conduction (bande regroupant les niveaux d’énergie théoriquement non occupés) se chevauchent, voire se confondent. Le niveau de Fermi (énergie du plus haut état quantique occupé par un électron à 0 K) est situé au cœur de cette bande commune et la simple agitation thermique permet à des électrons de devenir conducteur. Ceci fait des métaux de transition de bons, voire d’excellents conducteurs électriques (et thermiques, le même raisonnement s’appliquant aux phonons).
Remarque : la répartition des électrons, qui sont des fermions, entre les différents niveaux d’énergie, est régie par la statistique de Fermi-Dirac.
La liaison métallique ne s’applique pas qu’aux cristaux monométalliques. Elle permet aussi de constituer des alliages dans la mesure où les orbitales des couches d de tous les métaux de transition présentent les mêmes symétries.
Propriétés des métaux de transition
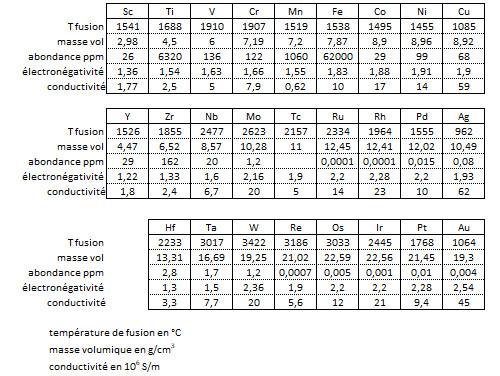
La liaison métallique explique un bon nombre des propriétés des métaux de transition et de leurs alliages, parmi lesquelles leur point de fusion et de vaporisation élevés et leur forte densité. La température de fusion de la plupart des métaux de transition est supérieure à 1400°C (elle peut même excéder 3000°C) à l’exception du cuivre, de l’argent et de l’or. Ce sont les métaux des colonnes du milieu du bloc d qui ont la température de fusion la plus élevée (nombre d’électrons non appariés le plus élevé). La température de vaporisation peut monter jusqu’à 6000°C pour le tungstène W !
La liaison métallique explique également les propriétés mécaniques des métaux de transition et de leurs alliages. Ils présentent en général une bonne résistance à la traction et une bonne dureté tout en restant ductiles : ils ne sont pas cassants et ne sont donc pas des matériaux fragiles.
Les propriétés électriques des métaux de transition sont à l’origine de leur caractère opaque, de leur coloration et de leur aspect réfléchissant. Le fluide d’électrons libres empêche en effet toute pénétration des ondes électromagnétiques, ce qui entraîne une réflexion spéculaire qui peut être légèrement colorée (or, cuivre) mais qui est le plus souvent argentée.
Les propriétés magnétiques dépendent quant à elles de la répartition des électrons dans les différentes orbitales (règle de Hund). Très logiquement, ce sont les matériaux qui ont un maximum d’électrons non appariés et pas de doublets qui présentent le plus fort paramagnétisme. C’est le cas du manganèse Mn (spin 5/2).
Un groupe à part : les platinoïdes
Le groupe de platinoïdes (PGM : platinum group metals) occupe une place à part. Ce groupe est composé du platine Pt, du palladium Pd, de l’iridium Ir, du ruthénium Ru, du rhodium Rh, du rhénium Re et de l’osmium Os. Ils font tous partie des lignes 5 et 6 du tableau de classification périodique des éléments. Ce sont des matériaux très denses (densité supérieure à 20g/cm3 pour certains), peu corrosifs et surtout assez peu ductiles.
Abondance dans la croûte terrestre
Le fer est, de très loin, le plus abondant des métaux de transition dans la croûte terrestre, suivi par le titane et le manganèse. Ce sont les seuls éléments de la liste qui dépasse le taux de 1/1000 en masse. Au-dessus de 1/10000 on trouve le zirconium, le vanadium, le chrome et le nickel. Le cuivre ne vient qu’en 8ème position et, compte tenu de son utilisation intensive dans l’industrie, c’est un matériau dont le coût ne cesse de croître. Le cobalt, l’yttrium, le scandium et le niobium sont dans la gamme des 25 ppm. Hafnium, tantale, tungstène et molybdène sont entre 3 et 1,2 ppm. Tous les autres sont des matériaux rares (0,01 ppm pour le platine, 0,004 ppm pour l’or) voire extrêmement rares (0,0001 ppm pour le ruthénium et le rhodium). Si tous les éléments dont le numéro atomique est inférieur à celui du fer ont été produits par la nucléosynthèse stellaire, tous les autres sont issus de l’explosion de supernovæ. Le fer est en effet l’élément dont le noyau a la plus grande stabilité (voir le post à ce sujet).
Oxydation
A la surface de la Terre, les métaux de transition existent la plupart du temps sous forme oxydée. La sous-couche d se prête bien à la formation d’oxydes. De manière très logique, le nombre de degrés d’oxydation que peut adopter un métal de transition augmente avec le nombre d’électrons non appariés de sa bande de valence (de gauche à droite dans le tableau de classification) puis diminue à partir du moment où les électrons commencent à s’apparier.
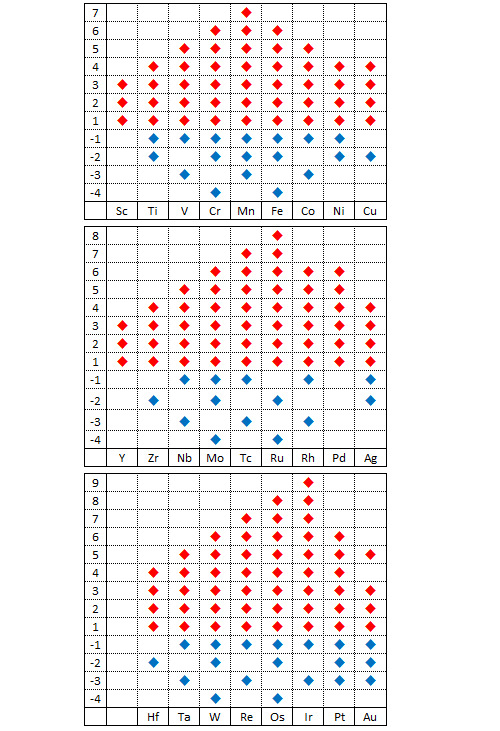
Le tableau qui précède récapitule les différents degrés d’oxydation possibles pour les métaux de transition. Le champion toutes catégories est l’iridium Ir : un tetraoxyde d’iridium IrO4+ a été synthétisé récemment dans lequel il présente un degré d’oxydation +9. Les degrés d’oxydation observés dans la nature sont moins nombreux et l’ion permanganate MnO4- (+7) est l’un des composés métalliques courants avec le degré d’oxydation le plus fort. Le permanganate de potassium est un décapant et un décolorant. Il a été utilisé pendant la guerre comme carburant.
Il existe de nombreux composés métalliques avec un degré d’oxydation zéro (en particulier les composés métal carbonyle comme le pentacarbonyle de fer Fe(CO)5 ou le tetracarbonyle de nickel Ni(CO)4). Les carbonyles de métal sont très utilisés comme catalyseurs ou comme précurseurs en chimie organique. Les degrés d’oxydation négatifs se rencontrent principalement dans les composés organométalliques. C’est le cas par exemple dans l’ion hexacarbonyle de vanadium [V(CO)6]-.
Parmi les métaux de transition, on classe à part les métaux dits nobles compte tenu de leur résistance à la corrosion. Cette famille regroupe l’or Au, l’argent Ag ainsi que tous les métaux platinoïdes à l’exception du rhénium Re. Ces métaux peuvent exister sous forme oxydée mais leur potentiel d’oxydo-réduction positif et relativement élevé rend cette oxydation rare. L’éclat pratiquement inaltérable de l’or en a fait un matériau très prisé dans pratiquement toutes les civilisations.
Composés complexes
Les métaux de transition sont particulièrement intéressants du fait de leur capacité à se coordonner avec des ligands pour former des composés complexes. La chimie des composés complexes est particulièrement riche. Une série de posts lui est consacrée. Les complexes organométalliques jouent un grand rôle en chimie organique : de façon naturelle (dans la chlorophylle, l’hémoglobine et certaines vitamines par exemple) ou artificielle (comme médicaments ou au titre de catalyseurs dans la chimie de synthèse).
Pour en savoir plus :
post sur le tableau de classification des éléments
post sur la nucléosynthèse
post sur le noyau des atomes
post sur l’oxydoréduction
post sur le degré d’oxydation
post sur les liaisons chimiques
post sur les complexes
post sur les complexes (approche covalente)
post sur les propriétés magnétiques
post sur le fer
post sur le haut-fourneau
index
#chimie#métal#métal de transition#métaux#fer#cuivre#chrome#platine#palladium#rhodium#catalyse#catalyseur#oxydoréduction#complexe#organométallique#liaison métallique#valence#coordination#iridium#vanadium#métal carbonyle#manganèse#métal noble#conductivité
0 notes
Text
Complexes et ligands : quelques exemples
Dans les post précédents, nous avons analysé la notion de composé complexe sur un plan plutôt théorique et nous avons établi quelques règles à leur sujet (nommage, règle des dix-huit électrons). Nous allons maintenant donner des exemples illustrant la très grande variété des composés complexes.

Complexes aquo et hydroxo
La plupart des cations métalliques forment des complexes en solution. L’ion hexaaquo chrome (III) [Cr(H20)6]3+ ou le composé complexe hexaaquo titane (III) déjà cité en sont des exemples. En solution basique il se forme des complexes mixtes avec les ions hydroxyles présents dans l’eau, comme dans le cas du tetraaquo dihydroxo fer(II) Fe(H2O)4(OH)2 ou du pentaaquo hydroxo chrome (III) Cr(H2O)5(OH)2+. Comme nous l’avons vu dans le post consacré à l’approche covalente, la présence de deux ligands hydroxo en position cis peut conduire à la formation d’un complexe ponté, comme c’est le cas dans l’ion [(Fe(H20)4)2(mu-OH)2]4+.

Les ligands H2O et hydroxo se substituent facilement à un ligand plus faible, comme dans le cas du dichloro tétraaquo fer (III) [FeCl2(H2O)4]+. Le triaquo tricarbonyl ruthénium (II) [Ru(CO)3(H2O)3]2+ associe ligands H2O et ligands carbonyles. Des chercheurs ont récemment synthétisé un ion hydrido triaquo dicarbonyl ruthénium (II) [RuH(CO)2(H2O)3]+ avec trois types de ligand différents.
Nota : dans certains cas, des molécules H2O peuvent intervenir indirectement dans la constitution de sels de composés complexes sous forme cristalline. C’est le cas avec l’ion [FeCl2(H2O)4]+. Il forme avec l’ion chlorure un sel qui cristallise sous forme hydratée pour donner le chlorure de fer (III) hexahydraté dont la formule est [FeCl2(H2O)4]Cl.2H2O. (Cette notation signale que deux molécules H2O participent à l’édifice cristallin avec les anions chlorure et les cations dichloro tétraaquo fer (III).) Les liens entre les deux molécules H2O et les autres nœuds du cristal sont cette fois de nature différente : pont hydrogène ou forces de Van der Waals.
Complexes azotés
De par sa configuration électronique, l'azote se prête à la constitution de différents types de ligands, aussi bien sous sa forme réduite (ammino, amido) qu'oxydée (nitro, nitrosyl, nitrito). Nous avons cité dans un post précédent le diammino dichloro platine (II) [PtCl2(NH3)2] (CDDP), un complexe utilisé dans les traitements anticancéreux. L’ion tétraammino cuivre (II) [Cu(NH3)4]2+ est le composant principal d’un pigment bleu céleste utilisé en peinture. Il s’hydrate dans l’eau pour donner l’ion [Cu(H20)2(NH3)4]2+. Le Co(H20)(NH3)53+ associe 5 ligands amine et un ligand H2O.
Le chlorure de nitropentaammino cobalt (III) [Co(NH3)5(NO2)]Cl2 est un pigment orange du plus bel effet. Il combine ligand ammino et nitro. L'ion nitropentaammino cobalt possède une forme isomère avec un ligand nitrito dont la formule est [Co(NH3)5(ONO)]2+.
Les sels de Roussin sont des complexes pontés comportant des ligands nitrosyles. Dans le sel noir de Roussin K[Fe4S3(NO)7] quatre atomes de fer sont pontés par le biais de ligands soufre :S. Le sel rouge de Roussin dont la formule est K2[Fe2S2(NO)4]) présente une configuration particulière puisqu'en plus du pontage par des ligands soufre les deux atomes de fer entretiennent une liaison directe entre eux. Zacharie Roussin est un chimiste français, pharmacien des armées, qui vécut au XIXème siècle.

Complexes carbonés
Il existe une multitude de complexes organométalliques, nous en citons quelques-uns plus bas. Parmi les complexes carbonés, les complexes cyano et carbonyle ont un rôle particulier. Nous avons cité l'ion hexacyano ferrate dans un post précédent. Le ligand cyano forme des ions complexes hexacyano ou tetracyano avec différents métaux (hexaxyanochromate [Cr(CN)6]3-, hexacyanocobaltate [Co(CN)6]3-, tétracyanocuprate [Cr(CN)4]2-...). L'anion nitroprussiate [Fe(CN)5NO]2− est un ion pentacyano nitrosyle ferrate. Le nitroprussiate de sodium dihydraté Na2[Fe(CN)5NO].2H2O entre dans la composition de vasodilatateurs.
Le ligand carbonyle forme quant à lui des complexes hexacarbonyle ou tétracarbonyle (molybdène hexacarbonyle Mo(CO)6, manganèse hexacarbonyle Mn(CO)6, nickel tétracarbonyle Ni(Co)4...). Nous avons indiqué dans le post sur l’approche covalente que des complexes pouvaient se former sur des polymères métalliques. C’est le cas pour le dodécacarbonyle tétracobalt Co4(CO)12. Les quatre atomes de cobalt forment un tétraèdre. Chacun d’entre eux est porteur de trois liaisons avec un ligand carbonyle. Le doécarbonyle trifer Fe3(CO)12 est basé sur un triangle de trois atomes de fer. L’un de ces atomes porte 4 liaisons avec des ligands carbonyles et deux liaisons avec les atomes de fer voisins. Les deux autres ne portent qu’une liaison avec l’atome de fer central et 5 liaison avec des ligands carbonyles. Deux de ces ligands sont pontés avec l’autre atome de fer.

On trouve le ligand carbonyle en combinaison avec le ligand nitrosyle dans des complexes comme le Co(NO)(CO)3 ou le Fe(CO)2(NO)2.
Complexes hydrido et halogéno
Les halogènes sont des ligands omniprésents. Ils forment des composés octaédriques comme l’hexafluoronickelate de potassium K[NiF6] ou l’hexachloro nickelate de sodium Na[NiCl6] mais aussi, comme on l’a vu, des complexes mixtes avec d’autres ligands, comme dans le dichloro tétraaquo chrome (III) [CrCl2(H2O)4]+ déjà évoqué. On retrouve également le ligand chloro dans de nombreux composés organométalliques. Dans le sel de Zeise K[PtCl3(C2H4)].H2O le platine porte un ligand éta2-éthylène et trois ligands chloro. Dans le dimère du rhodium Rh2Cl2(C2H4)4 chaque atome de rhodium porte deux liaisons éta2 avec des ligands éthylène et deux liaisons avec des ligands chloro qui assurent un pont entre les deux atomes métalliques.

Le ligand hydrido intervient moins fréquemment. On le trouve par exemple dans le dihydrido tétracabonyle fer (II) Fe(H)2(CO)4, aussi appelé hydrure de fer tétracarbonyle.
Complexes métal phosphine
L’hydrido carbonyl tris(triphénylphosphine) rhodium RhH(CO)(PPh3)3 est un complexe métal phosphine. L’atome de rhodium porte trois ligands triphénylphosphine P(C6H5)3 (la triphénylphosphine est généralement notée PPh3) en plus du ligand carbonyle et du ligand hydrido. Ce complexe est utilisé dans l’industrie des parfums. Le complexe de Vaska trans-chlorocarbonylbis(triphénylphosphine) iridium(I) comporte quant à lui 2 ligands triphénylphosphine.

Le bis(diphénylphosphino)éthane Ph2P(CH2)2PPh2 est un ligand chélatant, comme dans le complexe PtI(CH3)3(Ph2P(CH2)2PPh2) où il intervient avec un ligand Iodure et trois ligands méthyles.
Complexes organométalliques
Revenons sur les complexes organométalliques. Un composé organométalliique est un composé dans lequel il y a au moins une liaison entre un atome de métal et un atome de carbone. Les complexes organométalliques les plus simples les complexes métal alkyle. L’hexaméthyle tungstène W(CH3)6 ou le tétraméthyle titane Ti(CH3)4 en sont des exemples. La plupart des complexes métal alkyle associent d’autres types de ligand aux ligands alkyles. C’est le cas de l’ion triaquo dicarbonyl éthyl ruthénium (II) [Ru(C2H5)(CO)2(H2O)3]+ qui comporte deux ligands carbonyle, un ligand H2O et un ligand éthyle .CH2CH3 dans une configuration octaédrique. Par ailleurs nous avons cité dans un post précédent le Pt4Cl4(CH3)12, un édifice polyatomique cubique qui comporte 12 ligands méthyles.

Les carboxylates (R-C(=O)O-) constituent également des ligands que l’on rencontre couramment en chimie organique. Le diacétate palladium (II) Pd(CH3COO) en est un exemple. L’acétylacétonate H3CCOCHOCCH3)- forme lui aussi de nombreux complexes (notation condensée acac). C’est un ligand bidenté chelatant. Le TiCl2(acac)2 est un complexe rouge en configuration octaédrique. Dans le V(O)(acac)2 la structure est pyramidale à base carrée. La pointe de la pyramide est constituée par l’atome d’oxygène lié au vanadium, les sommets du carré sont les quatre atomes d’oxygène des ligands acac. Le tris(acétylacétonate) manganèse Mn(acac)3 a une structure octaédrique distordue��dans la mesure où les 6 liaisons se combinent deux par deux pour amarrer les 3 molécules acac.

Lorsqu’il est en position chelatante la configuration du ligand est celle indiquée dans l’encart en haut à droite. Il se forme une liaison délocalisée entre le groupe central -C(=0)-CH-(C=O)- et le métal.
Nous avons par ailleurs déjà cité plusieurs fois le cas des liaisons pi (PtCl3(éta2-C2H4) ou PtCl2(C8H12), avec deux liaisons éta2 pontée sur l’atome de platine). La découverte du ferrocène Fe(C5H5)2, dans lequel le dicyclopentadiényle C5H5 est un ligand éta5, a joué un grand rôle dans la compréhension de ce type de liaison. L’atome de fer y est pris en sandwich entre deux ligands cyclopentadiényle. Dans le composé (éta6-C6H6)Ru2Cl2(mu-Cl)2 chaque atome de ruthénium entretient une liaison éta6 avec une molécule de benzène, une liaison de coordination avec un atome de chlore en position terminale et une liaison pontante avec l’autre atome de ruthénium par le biais de deux ligands chlore : bel exemple qui combine hapticité et liaison pontante.
L’éthylènediamine H2N-CH2-CH2-NH2 (formule condensée C2H8N2) est un exemple de ligand bidenté du fait de ses deux fonctions amine -NH2. C’est un lui aussi un chélate. Dans le dichloro(éthylènediamine) de palladium (II) PdCl2(C2H8N2) l’éthylènediamine se coordonne avec l’ion palladium (II) par ses deux extrémités. Le chlorure de dichlorobis(éthylènediamine) cobalt(III) est un sel composé d’un anion chlorure et d’un cation [CoCl2(C2H8N2)2]+. Le cation dichlorobis(éthylènediamine) cobalt(III) comporte 2x2 liaisons de coordination puisque l’atome de cobalt est relié à 4 atomes d’azote.
Citons enfin l’éthylènediamine tétraacétique C10H16N2O8 (EDTA), un ligand hexadenté au pouvoir chelatant fort utilisé comme antidote lors des empoisonnements par des métaux lourds.
Chimie des complexes
La chimie des complexes est riche, en particulier celle des complexes organométalliques. Ils sont sujets à différents types de réactions :
hydrolyse, oxydation
complexation/dissociation

substitution d’un ligand par un autre ligand

addition oxydante

élimination réductrice

migration entre ligands

ainsi que toute sorte de réactions dues aux propriétés des ligands (addition, substitution...).
Applications
Les composés complexes sont omniprésents en chimie et dans le monde qui nous entoure. Ils connaissent des utilisations nombreuses. Ils interviennent tout d’abord dans la chimie du vivant : la chlorophylle est un complexe du magnésium, l’hémoglobine un complexe du fer. Ils connaissent également des applications médicales. Les complexes du platine sont utilisés comme produits anticancéreux. Les produits de contrastes utilisés en IRM sont des complexes. Nous avons vu qu’ils étaient à la base de nombreux pigments. On les utilise aussi dans l’industrie chimique : dans la métallurgie, la galvanoplastie et en chimie analytique. En chimie organique ce sont de pr��cieux catalyseurs. Et souvenons-nous que les sels d’argent de la photo argentique étaient aussi des complexes !
De précieux catalyseurs
Un catalyseur est un composé qui facilite une réaction chimique tout en restant inchangé à l’issue de celle-ci. Les complexes organométalliques jouent ce rôle en chimie organique. Sans rentrer dans des considérations théoriques complexes nous allons expliquer de manière schématique comment ils interviennent. Une réaction ne peut avoir lieu que si les deux composants intervenant dans celle-ci se rencontrent et que si l’énergie nécessaire est disponible (sous forme d’énergie cinétique ou de rayonnement). Pour que la collision soit efficace, il faut de plus que les molécules soient convenablement orientées.
En l’absence de catalyseur, le processus peut être lent, consommateur d’énergie et inefficace. La présence d’un complexe organométallique peut changer tout cela. Un tel complexe est une molécule de taille respectable. Sa configuration électronique la rend réactive. La probabilité qu’elle se combine avec l’un des réactifs, puis l’autre, est plus grande que la probabilité de ceux-ci de se rencontrer. Une fois piégés par le complexe, les réactifs sont à proximité l’un de l’autre et ils ont tout le temps de réagir entre eux. Le processus se termine par une séparation entre le complexe et le produit de la réaction. L’action du catalyseur de Wilkinson dans l’hydrogénation des alcènes est un exemple que l’on trouve dans tous les manuels traitant des propriétés des composés organométalliques. Le catalyseur de Wilkinson est un chlorotris(triphénylphosphine) rhodium (II) Rh(PPh3)3Cl. Dans un solvant organique il libère un ligand triphénylphosphine :

La réaction suivante est une addition oxydante :

On introduit ensuite l’alcène R-CH=CH2. Une liaison éta2 avec l’alcène se substitue à la liaison avec le solvant qui n’est que faiblement coordonné :

Il y a ensuite migration de l’un des ligands H vers l’alcène :

puis dissociation :

La boucle est bouclée et le catalyseur est de nouveau disponible.
Les catalyseurs les plus fréquemment rencontrés en synthèse organique sont ceux construits autour de métaux appartenant aux triades d8-d9-d10 : fer, cobalt, nickel ; ruthénium, rhodium, palladium ; osmium, iridium, platine. Si les trois premiers sont abondants dans la croûte terrestre, le palladium et le platine sont plus rares (respectivement 0,015 ppm et 0,01 ppm) et les quatre autres particulièrement rares (moins de 0,001 ppm, voire 0,0001 ppm).
Pour en savoir plus :
post sur la classification périodique des éléments
post sur les liaisons chimiques
post sur les orbitales moléculaires
post sur la géométrie des molécules
post sur les complexes et les ligands : l’approche ionique
post sur les complexes et les ligands : l’approche covalente
post sur les acides et les bases
post sur les sels
index
1 note
·
View note