#oxydoréduction
Text
youtube
#Combustion#Réaction#Exothermique#Oxydoréduction#Explosion#Feu#Combustible#Solide#Gaz#Métal#Huile#Cuisson#Comburant#Activateur#Radicaux#Extinction#Liquide#Flamme#Youtube
0 notes
Video
youtube
La nouvelle est sortie ! Le glutathion est reconnu comme notre "maître antioxydant". Tous les autres antioxydants en dépendent pour leur bon fonctionnement. Découvrez pourquoi le glutathion a atteint ce statut.Les antioxydants sont des molécules qui, lorsqu'elles sont en contact avec d'autres produits chimiques, ralentissent ou empêchent l'oxydation d'autres produits chimiques. L'oxydation fait partie d'une réaction redox qui transfère des électrons d'une substance à un agent oxydant. La réaction génère des radicaux libres, conduisant à une réaction en chaîne
https://immunotec.com/sdion/shop/product/0005000
#glutathion #sante #antioxydant #maitreantioxidant #vitamines #supplément #vieillissement #homme #femme #sportif #oxidation #precurseur #nouvelle #fonction #fonctionnement #statut #science #recherche #radicauxlibres #oxydoréduction #électron #réaction #molécule #produit #produitchimique
0 notes
Video
vimeo
Les méthodes de protection du métal
Extrait du projet “Du monde des objets au monde de la matière”
Épisode 3/3
Conception, réalisation et voix off : Tiphaine Roland
Vidéo réalisée dans le cadre d'un projet de diplôme de DSAA Design d'Illustration Scientifique à l'École Estienne - Promotion 2018
En partenariat avec Jean-Pascal Mauvoisin
Musique : Broke For Free - Summer Spliffs
Remerciements : Pierre Vaxelaire, Michèle Garrec, l'équipe enseignante du DSAA
Retrouvez le projet en entier sur https://objetsetmatiere.wixsite.com/rolandmauvoisin
#oxydation#oxydoréduction#corrosion#physique#matériaux#chimie#fer#vulgarisation#vulgarisation scientifique#science#atome#ion#video#stop motion#didactique#didactique visuelle
5 notes
·
View notes
Text
La photosynthèse et la respiration moléculaire
Pour la bonne compréhension de ce post, il est souhaitable de prendre connaissance au préalable du post sur les couples NAD/NADH et ADP/ATP.
La photosynthèse
La photosynthèse est un processus essentiel du cycle de la vie sur Terre. La photosynthèse permet à des organismes vivants de synthétiser des molécules organiques en utilisant l’énergie du rayonnement solaire. Il existe plusieurs formes de photosynthèse. Nous nous intéresserons plus particulièrement à la photosynthèse oxygénique qui est la forme la plus répandue aujourd’hui.
La photosynthèse oxygénique synthétise des glucides à partir de dioxyde de carbone (CO2), d’eau (H2O) et de photons. Au terme de ce processus, la photosynthèse libère de l’oxygène (O2). Elle permet ainsi de maintenir constant le taux de dioxygène et le taux de CO2 dans l’air. Elle est donc au cœur du cycle du carbone qui entretient la vie sur Terre.
Le CO2 est un composé chimique stable. Sa transformation en glucose est possible par oxydoréduction. En l’occurrence, il s’agit d’une réduction du CO2. Cette réaction nécessite donc la présence d’un élément réducteur (on emploie aussi le terme de donneur d’électrons). Mais ce n’est pas suffisant : cette réaction est endothermique. Elle requiert donc un apport d’énergie.
Un processus en deux temps
La photosynthèse se déroule en deux temps. Le premier temps dépend de la présence de lumière. C’est celui au cours duquel sont produites les coenzymes réductrices du CO2, le NADPH, et les coenzymes apporteuses d’énergie, l’ATP. L’eau joue un rôle essentiel dans ces réactions. Le deuxième temps est celui de la synthèse des glucides. On a donné à cette phase le nom de fixation du carbone. Elle est indépendante de la présence de lumière.
Nota : les coenzymes sont des molécules organiques nécessaires à l’action catalytique d’une enzyme. Une enzyme est une protéine dotée de propriétés catalytiques. Un catalyseur est un composé chimique intervenant au cours d’une réaction mais qui est restitué à l’état initial à l’issue de celle-ci.
Absorption de l’énergie lumineuse
L’énergie lumineuse est absorbée par des pigments appelés chlorophylle. Ces pigments se trouvent dans des microstructures appelées chloroplastes situées principalement dans les feuilles des végétaux. L’absorption de lumière excite les électrons de molécules d’eau qui deviennent ainsi donneuses d’électrons. Ces molécules d’eau réagissent à leur tour avec une molécule organique appelée nicotinamide adénine dinucléotide phosphate (NADP) pour donner du NADPH, qui devient à son tour donneuse d’électrons (donc réductrice). Mais ce n’est pas tout car les molécules d’eau réagissent également avec un nucléotide appelé adénosine diphosphate (ADP) pour donner de l’ATP, adénosine triphosphate, une molécule dont le clivage par hydrolyse permettra de libérer de l’énergie. Cet ensemble de réactions peut s’écrire comme suit :
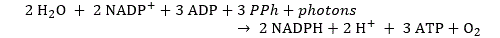
Dans cette formule, le symbole PPH représente un composé polyphosphate, nécessaire à la synthèse de l’ATP. Ce processus d’absorption produit de l’oxygène.
Fixation du carbone
La fixation du carbone peut se faire de différentes façons. L’un des cycles les plus courants est le cycle de Calvin. Au cours de ce cycle, le CO2 est tout d’abord fixé par un composé organique appelé ribulose-1.5-biphosphate (rubisco) présent dans les chloroplastes. Le composé formé est ensuite transformé en glucose en présence de NADPH (qui fournit les électrons) et d’ATP (qui fournit l’énergie). Cette réaction de réduction libère également de l’oxygène. A l’issue du cycle de Calvin, le nicotinamide et l’adénosine retrouvent leur forme initiale (NADP, ADP).
Nota : La ribulose H2C(OH)-(CHOH)2-C(=O)-CHOH est une cétose. La ribulose-1,5-biphosphate porte deux groupes phosphate à ses extrémités :
(HO)2P(=O)-O-CH2-C(=O)-(CHOH)2-CH2-O-P(=O)(OH)2.
Formule générique
Si on la représente de manière générique, la photosynthèse peut s’écrire sous la forme suivante :
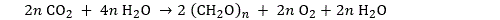
On “simplifie” en général cette formule en retirant 2nH2O de part et d’autre. L’une des formes les plus simples est celle qui conduit à la formation du glucose :

Cette formule est un raccourci qu’il ne faut pas prendre au pied de la lettre. Une telle réaction ne se produit jamais, c’est la synthèse du processus assez complexe détaillé ci-dessus. On remarquera également que l’on n’a pas fait figurer les couples NADP/NADPH et ADP/ATP qui interviennent au titre de cofacteur dans un processus catalytique.
Histoire de la photosynthèse oxygénique
La photosynthèse oxygénique est apparue il y a 2,5 milliards d’années. Elle était alors l’apanage de cyanobactéries. On a retrouvé des traces fossiles de ces cyanobactéries sous la forme de stromatolithes, des structures laminaires calcaires qui ressemblent à de gros choux. Elle s’est ensuite transmise par symbioses successives à des organismes plus évolués, des eucaryotes qui sont à l’origine des algues et des plantes. Sa généralisation a entraîné un bouleversement au sein de l’atmosphère, la grande oxydation, qui transformé radicalement la composition. L’atmosphère était alors riche en azote, en méthane et en dioxyde de carbone, elle est désormais toujours aussi riche en azote, mais l’oxygène occupe désormais la deuxième place, loin devant le CO2. Le méthane a pratiquement disparu. La quantité de CO2 transformé par photosynthèse est estimée entre 60 et milliards de tonnes chaque année, ce qui correspond à une énergie lumineuse 100 Terawatts environ.
Il existe d’autres formes de photosynthèse, plus archaïque, dans laquelle l’eau est remplacée par du sulfure d’hydrogène (H2S).
Respiration cellulaire
La respiration cellulaire est un processus encore plus complexe que la photosynthèse. Elle consomme du glucose, de l’eau et du dioxygène. Elle conduit à produire des molécules d’ATP par phosphorylation de molécules d’ADP. Elle se déroule d’abord dans le cytoplasme puis principalement au sein des mitochondries. Les molécules d’ATP produites par ce processus sont porteuses d’une énergie chimique qui est utilisée par l’organisme dans le cadre de ses différentes activités. L’énergie des molécules d’ATP est libérée par hydrolyse.
La respiration cellulaire comporte quatre phases :
la glycolyse qui conduit à la formation de pyruvate,
la conversion du pyruvate en acétyl-coenzyme A,
le cycle de Krebs qui libère la coenzyme, oxyde complètement le groupe acétyle et produit des molécules de NADH et de FADH2
la phosphorylation oxydative de molécules d’ADP grâce au potentiel électrochimique des molécules NADH et FADH2 et produit de nombreuses molécules d’ATP.
Glycolyse
La glycolyse est une réaction qui se produit dans le cytoplasme des cellules et qui « casse » en deux une molécule de glucose. Cette réaction conduit à la formation de pyruvate CH3COOH, de NADH et d’ATP. Le NADH est la forme réduite du NAD.
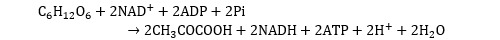
Conversion en acétyl-coA
Cette réaction se produit dans les mitochondries. Elle conduit à une décarboxylation du pyruvate (perte du groupe carboxyle -COOH). Le résidu, qui est un groupe acétyle, se lie à une coenzyme A pour former de l’acétyl-coA (acétyl-coenzyme A). De son côté, le groupe carboxyle réagit avec du NAD pour donner du NADH et du CO2.
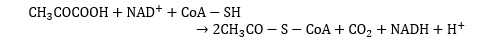
Cycle de Krebs
Le cycle de Krebs est un ensemble de réactions (une dizaine) qui se produisent dans les mitochondries. Les molécules d’acétyl-coA y subissent une succession de réactions chimiques qui conduisent à libérer le coenzyme A et oxydent complètement le groupe acétate. Ces réactions nécessitent de l’eau, de l’ADP, du NAD+ et du FAD (flavine adénine dinucléotide, un cofacteur d’oxydo-réduction dérivant de la vitamine B2). Les électrons libérés par cette réaction d’oxydation sont récupérés sous forme de NADH et de FADH2. Les produits de cette réaction sont le CO2, la coenzyme A qui reprend sa forme initiale, de l’ATP, du NADH et du FADH2 (la forme réduite du FAD).
Phosphorylation oxydative
T Les molécules NADH et FADH2 sont porteuses d’électrons à haut potentiel de transfert. En contact avec des complexes polypeptidiques de la membrane des mitochondries, le NADH et le FADH2 libèrent des e- et des H+.
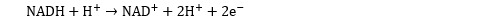
L’énergie libérée par le transfert des électrons aux protéines du complexe permet d’expulser des protons au travers de la membrane (on parle de pompe à protons). Ce processus entretient une charge négative sur le paroi interne de la membrane mitochondriale et une charge positive sur sa paroi externe. L’oxydation des molécules NADH et FADH2 permet ainsi de générer un potentiel électrochimique au niveau de la membrane. Ce potentiel est utilisé de la manière suivante :
des phosphates et des molécules d’ADP sont aspirées au travers de la membrane,
l’ADP est phosphorylé en ATP,
l’ATP est expulsé hors de la mitochondrie.
Le bilan de ce processus (qui est en fait une succession de réactions nécessitant la présence d’ATP synthase) est le suivant :
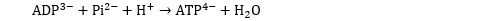
L’échange entre ADP3- et ATP4- au niveau de la membrane est réalisé par l’enzyme ADP/ATP translocase. Cet échange se traduit par la sortie d’une charge négative qui permet de maintenir constante la charge extérieure malgré l’action de la pompe à protons. (Les protons et les électrons se fixent au final sur des molécules d’oxygène pour former des molécules d’eau.)
Bilan de la respiration cellulaire
La respiration cellulaire est une succession impressionnante de réactions chimiques qui font intervenir quantité d’enzymes et de coenzymes. Mais si l’on fait le bilan final, on constate qu’elle ne consomme que du glucose, du dioxygène et de l’ADP. Les produits de la respiration cellulaire sont le CO2, l’eau et de l’ATP. C’est, d’une certaine façon, le processus inverse de la photosynthèse !
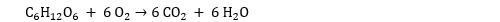
Ce processus est, en théorie, redoutablement efficace puisqu’une molécule de glucose produit 38 molécules d’ATP. En fait, le chiffre réel est inférieur car certains d’entre eux sont dissipés par des processus parasites.
La phosphorylation de l’ADP donne une très haute valeur énergétique à l’ATP : 30,6 kJ/mol. L’ATP est le fuel de la plupart des activités de l’organisme requérant de l’énergie.
Remarque : dans le cas d’un effort intense, il n’y a pas suffisamment d’oxygène pour alimenter la respiration cellulaire. On passe en mode « anaérobie ». Le pyruvate n’est pas transporté dans les mitochondries. IL demeure dans le cytoplasme où il est finalement dégradé et forme des déchets qui sont évacués par la cellule.
Rappel sur les réactions de réduction
Dans sa forme classique, on caractérise une réaction de réduction par le fait que le composé réduit « reçoit » un ou plusieurs électrons. On exprime ceci en attribuant à chaque élément intervenant dans une réaction un nombre d’oxydation dont on peut dire (de façon un peu sommaire) qu’il correspond à la charge électrique qu’il porte. Une réduction réduit ce nombre. Prenons par exemple la réaction suivante :

On peut la décomposer en :
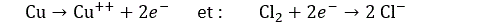
Le nombre d’oxydation du cuivre a augmenté (on dit que le cuivre a été oxydé) et celui du chlore a diminué (il est même devenu négatif). Il a été réduit. Comme on le voit, une réaction de réduction nécessite un donneur d’électrons (ici le cuivre). C’est l’élément réducteur.
Cette notion de réduction et de donneur d’électrons a été étendue à d’autres réactions chimiques. On sait en effet (voir le post au sujet des liaisons chimiques) que le modèle des liaisons ioniques ne permet pas de décrire toutes les liaisons chimiques et que, d’ailleurs, il est parfois difficile de faire la part entre différents modèles. Certaines liaisons sont « plutôt covalentes » tout en présentant une certaine polarité, d’autres sont « plutôt électrostatiques » sans l’être complètement. On a donc, par extension, introduit la notion de transfert fictif d’électrons. Prenons, par exemple, la réaction suivante qui est archi-connue :

Les liaisons au sein de la molécule H2O sont covalentes mais elle est polarisée. Le nuage électronique des électrons de valence est plutôt centré sur l’atome d’oxygène. Tout se passe comme s’il avait reçu une charge partielle 2ke- (k étant un nombre plus petit que 1) et que chaque atome d’hydrogène avait donné une charge partielle ke-. On peut donc dire que la molécule dioxygène a été réduite et que les molécules dihydrogène ont agi comme donneuses d’électrons.
Pour en savoir plus :
post sur les gènes et l’ADN
post sur les cellules eucaryotes et les chromosomes
post sur les bases nucléiques
post sur les gènes et les codons
l’ADN en bref
post sur les couples NAD/NADH et ADP/ATP
post sur le cycle du carbone
post sur l’oxydoréduction
post sur les glucides
post sur le phosphore
post sur l’azote en chimie organique
glossaire de biologie moléculaire
index
#chimie#photosynthèse#eau#co2#carbone#oxygène#terre#oxydation#réduction#oxydoréduction#rubisco#NADPH#atp#coenzyme#vivant#chlorophylle#protéine#respiration cellulaire#glycolyse#cycle de calvin#cycle de krebs#phosphorylation
1 note
·
View note
Photo

@brainzyme minerals explained: 💊magnesium: 56mg - needs:🧍♂️350 mg/d - 🧍♀️300mg/d 💡enzymatic cofactor/stabilise cells/ part of metabolism (syst of proteins, oxydoréduction, ATP, DNA, ionic regulation, physiology of all our systems)/neuromuscular excitability/ coagulation/ sedation/ defensive process ↘️ hyper emotional, shaking, headache, insomnia, larynx oppression, vertigo/dizziness, muscle cramps at night, tetany, stress, trophic disorder(hair, nails, teeth), risk factor for cardiovascular diseases 🔎:🦐🦞🦀🍤, whole grain 🍚🍞🥖 cereals, 🌰🥜nuts, 💧💦 water 💊zinc :13mg - needs: 🧍♂️11mg/d - 🧍♀️8mg/d 💡activity of 300 enzymes, stabilise structure via zinc finger for genes expression, proteins, hormones/metabolism of crabs, fats, proteins, nucleic acids/hormones and neurotransmitters synthesis, activity, stability, tissular fixation site/ digestive enzymes secretion/ metabolism vitamins (retinol, vit B6, folate)/ reproduction/sensitive fonction, immunity, antioxidant ↘️ bones growth retardation, low immune system with parasite and microbe infection augmentation, loss of taste, enteropathic acrodermatitis 🔎: 🥩,🦀🦞🦐 specially 🦪 ,🥚,🐟, 🍚🍞🥖cereals, pulses/leguminous, 🥛🧀 💊iron: 4,2 mg - needs: 🧍♂️9mg/d - 🧍♀️15mg/d 💡functional for constitution, haemoglobin, myoglobin, metabolic enzymes -> physiological process like O2 transport, cellular respiration, energy production/ non functional for storage/reserve ↘️ fatigue, palpitations, higher susceptibility to infections 🔎: 🥩,🥚,🥛🧀, pulses/leguminous, cereals 🍚🥖🍞, 🍇🍍, 🥬🥒🥦 💊iodine: 75 microg - needs: 🧍♂️🧍♀️150 microg/d 💡thyroid hormone T3 and T4: growth of organs and specially brain, metabolism of all cells ↘️metabolic activity slowed down, irreversible alteration of brain development (mental retardation), dis function of the thyroid, lower fertility rate 🔎: 🐟🦐🦞🦀🐚🦪,🥚,🧀🥛,iodised 🧂 💊chromium: 20 microg 💡crabs, fats and proteins homeostasis via optimised effect of insulin ↘️ lower tolerance to glucose, hyper insulinaemia, hyperglycaemia, higher cholesterol and triglycerides rates in blood, neurological signs 🔎: 🥩, oils, yeast, 🍞🥖, 🌰🥜, 🍚 cereals, 🐟 💊selenium ⬇ (à Brussels, Belgium) https://www.instagram.com/p/CAzmTWwJW9Y/?igshid=9a1gcluhy0pp
1 note
·
View note
Text
Je suis pas du genre à m'étaler (mouahahah vous n'êtes pas prêt) d'habitude je sort des simples anecdote mais là j'ai besoin de discuter avec ma conscience et de poser ça sur le papier.
C'est un premier billet qui ne sera pas jouasse mais qui vas me faire du bien je pense.
Alors voilà, je suis un mec (woaaw quel révélation) le genre de mec qu'on crois normal et pourtant en faite pas du tout.... J'ai beaucoup dissimulé ce que je ressentais pour éviter de m'exposer, j'ai menti, beaucoup et même trop, à cause de ça j'ai perdu beaucoup de gens autour de moi. Je regrette certains mais beaucoup d'autre moins. La faute à cette lassitude qui me gagne face à des gens normaux, banal avec leurs petite routine et leurs petit train train quotidien, qui ont peur de sortir de leurs zone de confort.
Quand une opportunité se présente, j'ai tendance à sauter dessus comme un lion (c'est mon signe astro remarque) en amour j'ai été d'échec en échec total mais étonnement, je ne regrette rien. Niveau plan cul c'était pas jouasse, je suis pas le genre de type a aimer les plan cul même si ça détend un peu, j'aime terriblement ressentir quelque chose j'aime mes sentiment j'aime quand les mots "je t'aime" viens du plus profond de mes tripes et se répand dans l'air tel un parfum, le genre qui reste et qui remplis d'un sentiment de plénitude.
Au travail je suis terriblement curieux dévoué et spontané, je brusque mon monde alors que je veux juste un peu de reconnaissance... J'ai appris récemment et grâce à une femme qui compte énormément pour moi qu'il y a bien plus important que ça, il y a l'amour (je sais les gens normaux diraient que je suis cucul mais pour moi c'est un ingrédient essentielle)
Je suis conscient de ce que je ressent pour cette femme en si peu de temps conscient que j'ai été trop vite et que je (risque?) la perd peu a peu (j'ai cet peur irrationnel qui m'envahit souvent) conscient que je lui fait peur parce que je suis comme un barrage d'émotion sur le point de craquer mais grâce à elle, ce barrage ne délivre plus des litre et des litres mais des mililitre savamment préparé tel un chimiste en oxydoréduction. J'aimerais réaliser tellement de choses avec elle mais je veux y aller progressivement centimètres après centimètre, la vie est trop courte mais elle est belle surtout quand elle est là avec ses magnifique cheveux roux et ce regard rêveur, j'arrive presque toujours à savoir ce qu'elle pense mais des fois tel un démon tapis dans l'ombre je comprend que quelque chose ne vas pas et cette chose je la sais autant qu'elle me terrifie, je ne suis peut être que de passage dans sa vie... Ce serais cruel que de la forcer a m'aimer et ce n'est pas mon souhait même si elle je la regretterais longtemps.
Tout le monde me pose la même question quand j'ai commencé à éprouver quelque chose j'ai été trop bavard. Pourquoi elle et pas une autre? tu en trouvera d'autre qui peuvent valoir plus le coup non?
Déjà ce jugement de valeur m'insupporte au plus haut point, ensuite je dirais que c'est ma vie ma décision et pour finir elle n'est pas comme les autres, banale, Fade, vide...
Je m'explique :
J'ai été sur tinder et outre les Fake j'ai discuté avec trois femme : pas de passion, pas de désir de se sentir femme autrement qu'en fondant une famille, pas cette étincelle de je ne sais quoi qui fait que la vie est plus compliqué mais en même temps tellement plus puissante plus augmentée plus belle. Comprenez bien que j'ai toujours dû m'adapter à ce monde et cacher mes sentiments... Je ne peux plus vivre comme ça je suis un être qui bouillonne de millier d'émotion et pour moi que ce soit juste un bisous ou faire l'amour passionnément je vie tout plus fort que tout le monde et c'est en ça que je la trouve exceptionnelle, on est pareil sur ce point en plus d'un parcours de vie si proche du mien.
Créatif et passionné j'aime tellement imaginer et créer de nouvelles choses, voir de nouvelle chose, vivre de nouvelles expériences, je ne me lasse jamais de vivre même dans les pire moments.
Ce monde n'est pas vraiment pour moi mais rien ne m'empêche de m'en créer un. Un monde fait de voyage d'aventure de nouveauté et je pense que ce Tumblr sera mon carnet de voyage et mon échappatoire. AUSSI !!! toi oui toi qui viens jeter un œil j'espère que tu ne me jugera pas et surtout que tu te reconnaîtra dans ce que j'écris et que je te donnerais envie de voyager et de vivre des aventures comme moi.
5 notes
·
View notes
Photo

God bless Verseau et son incroyable oxydoréduction ! 🚜🇫🇷🌿🐞🌞 (à Étretat)
0 notes
Video
vimeo
Corrosion et passivation
Extrait du projet “Du monde des objets au monde de la matière”
Épisode 2/3
Conception, réalisation et voix off : Tiphaine Roland
Vidéo réalisée dans le cadre d'un projet de diplôme de DSAA Design d'Illustration Scientifique à l'École Estienne - Promotion 2018
En partenariat avec Jean-Pascal Mauvoisin
Musique : Broke For Free - Summer Spliffs
Remerciements : Pierre Vaxelaire, Michèle Garrec, l'équipe enseignante du DSAA
Retrouvez le projet en entier sur https://objetsetmatiere.wixsite.com/rolandmauvoisin
#oxydoréduction#oxydation#corrosion#fer#physique#chimie#aluminium#matériaux#vulgarisation#vulgarisation scientifique#science#atome#ion#video#stop motion#didactique#didactique visuelle
4 notes
·
View notes
Video
vimeo
La réaction d’oxydoréduction
Extrait du projet “Du monde des objets au monde de la matière”
Épisode 1/3
Conception, réalisation et voix off : Tiphaine Roland
Vidéo réalisée dans le cadre d'un projet de diplôme de DSAA Design d'Illustration Scientifique à l'École Estienne - Promotion 2018
En partenariat avec Jean-Pascal Mauvoisin
Musique : Broke For Free - Summer Spliffs
Remerciements : Pierre Vaxelaire, Michèle Garrec, l'équipe enseignante du DSAA
Retrouvez le projet en entier sur https://objetsetmatiere.wixsite.com/rolandmauvoisin
#oxydoréduction#oxydation#corrosion#fer#physique#matériaux#chimie#vulgarisation#vulgarisation scientifique#science#atome#ion#video#stop motion#didactique#didactique visuelle
2 notes
·
View notes
Text
Les métaux de transition
Les métaux de transition sont les éléments du bloc d du tableau de classification périodique de Mendeleïev. Les éléments de cette famille sont ceux dont la bande de valence présente une couche d incomplètement remplie. Cette famille inclut les éléments dont la bande de valence a la configuration suivante :
4s2, 3dx
5s2, 4dx
6s2, 4f14, 5dx
x étant inférieur ou égal à 10. Les éléments de la rangée 7 sont exclus de la famille (ils sont classés dans celle des transactinides). Le lanthane La, premier élément de la rangée 6, est attribué quant à lui à la famille des lanthanides. Le zinc Zn, le cadmium Cd et le mercure Hg, qui font partie du bloc d, ne sont pas des métaux de transition puisque leur sous-couche d est complète. Ils ont d’ailleurs des caractéristiques différentes. Leur température de fusion en particulier est beaucoup plus basse que celle des autres éléments du bloc d : le mercure est liquide à température ambiante ! On les classe dans la famille des métaux pauvres. La famille des métaux de transition comporte 26 éléments. On notera que, parmi ces éléments, le technétium Tc est radioactif (Le 99Tc a une demi-vie de 4,2 millions d’année).
Remarque : certains métaux de transition peuvent avoir une configuration du type ns1, (n-1)dx.
Liaison métallique
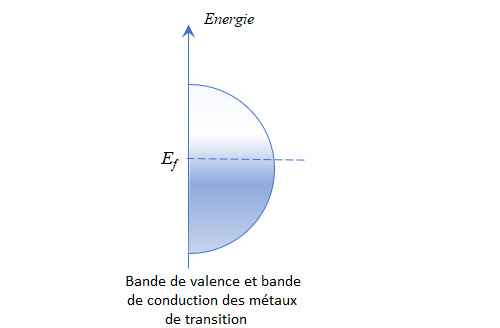
L’une des spécificités de ces éléments tient à leur propension à former des cristaux au sein desquels ils sont reliés par une liaison appelée liaison métallique. La liaison métallique est assurée par un nuage électronique délocalisé qui s’étend à tout le cristal (on parle de fluide d’électrons). La géométrie des orbitales de la couche d et le fait qu’elle ne soit pas remplie permet ce type de liaison entre cations métalliques, liaison qui se propage du fait des symétries du cristal. Le principe d’exclusion de Pauli implique cependant une différenciation entre les niveaux d’énergie des électrons de ce nuage délocalisé. Du fait du nombre considérable d’électrons de valence au sein d’un seul cristal, cela conduit à une multitude de niveaux espacés d’un écart infinitésimal. On se retrouve au final avec une bande d’énergie qu’on peut assimiler à un continuum.
Une autre caractéristique de ces éléments est que la bande de valence et la bande de conduction (bande regroupant les niveaux d’énergie théoriquement non occupés) se chevauchent, voire se confondent. Le niveau de Fermi (énergie du plus haut état quantique occupé par un électron à 0 K) est situé au cœur de cette bande commune et la simple agitation thermique permet à des électrons de devenir conducteur. Ceci fait des métaux de transition de bons, voire d’excellents conducteurs électriques (et thermiques, le même raisonnement s’appliquant aux phonons).
Remarque : la répartition des électrons, qui sont des fermions, entre les différents niveaux d’énergie, est régie par la statistique de Fermi-Dirac.
La liaison métallique ne s’applique pas qu’aux cristaux monométalliques. Elle permet aussi de constituer des alliages dans la mesure où les orbitales des couches d de tous les métaux de transition présentent les mêmes symétries.
Propriétés des métaux de transition
La liaison métallique explique un bon nombre des propriétés des métaux de transition et de leurs alliages, parmi lesquelles leur point de fusion et de vaporisation élevés et leur forte densité. La température de fusion de la plupart des métaux de transition est supérieure à 1400°C (elle peut même excéder 3000°C) à l’exception du cuivre, de l’argent et de l’or. Ce sont les métaux des colonnes du milieu du bloc d qui ont la température de fusion la plus élevée (nombre d’électrons non appariés le plus élevé). La température de vaporisation peut monter jusqu’à 6000°C pour le tungstène W !
La liaison métallique explique également les propriétés mécaniques des métaux de transition et de leurs alliages. Ils présentent en général une bonne résistance à la traction et une bonne dureté tout en restant ductiles : ils ne sont pas cassants et ne sont donc pas des matériaux fragiles.
Les propriétés électriques des métaux de transition sont à l’origine de leur caractère opaque, de leur coloration et de leur aspect réfléchissant. Le fluide d’électrons libres empêche en effet toute pénétration des ondes électromagnétiques, ce qui entraîne une réflexion spéculaire qui peut être légèrement colorée (or, cuivre) mais qui est le plus souvent argentée.
Les propriétés magnétiques dépendent quant à elles de la répartition des électrons dans les différentes orbitales (règle de Hund). Très logiquement, ce sont les matériaux qui ont un maximum d’électrons non appariés et pas de doublets qui présentent le plus fort paramagnétisme. C’est le cas du manganèse Mn (spin 5/2).
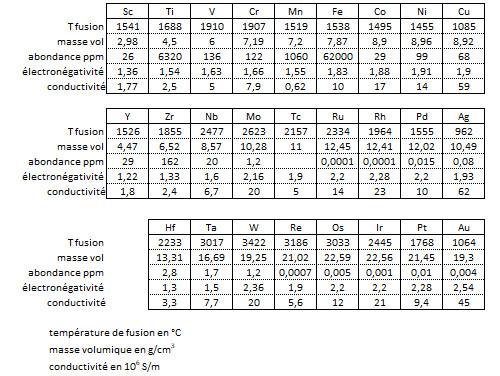
Un groupe à part : les platinoïdes
Le groupe de platinoïdes (PGM : platinum group metals) occupe une place à part. Ce groupe est composé du platine Pt, du palladium Pd, de l’iridium Ir, du ruthénium Ru, du rhodium Rh, du rhénium Re et de l’osmium Os. Ils font tous partie des lignes 5 et 6 du tableau de classification périodique des éléments. Ce sont des matériaux très denses (densité supérieure à 20g/cm3 pour certains), peu corrosifs et surtout assez peu ductiles.
Abondance dans la croûte terrestre
Le fer est, de très loin, le plus abondant des métaux de transition dans la croûte terrestre, suivi par le titane et le manganèse. Ce sont les seuls éléments de la liste qui dépasse le taux de 1/1000 en masse. Au-dessus de 1/10000 on trouve le zirconium, le vanadium, le chrome et le nickel. Le cuivre ne vient qu’en 8ème position et, compte tenu de son utilisation intensive dans l’industrie, c’est un matériau dont le coût ne cesse de croître. Le cobalt, l’yttrium, le scandium et le niobium sont dans la gamme des 25 ppm. Hafnium, tantale, tungstène et molybdène sont entre 3 et 1,2 ppm. Tous les autres sont des matériaux rares (0,01 ppm pour le platine, 0,004 ppm pour l’or) voire extrêmement rares (0,0001 ppm pour le ruthénium et le rhodium). Si tous les éléments dont le numéro atomique est inférieur à celui du fer ont été produits par la nucléosynthèse stellaire, tous les autres sont issus de l’explosion de supernovæ. Le fer est en effet l’élément dont le noyau a la plus grande stabilité (voir le post à ce sujet).
Oxydation
A la surface de la Terre, les métaux de transition existent la plupart du temps sous forme oxydée. La sous-couche d se prête bien à la formation d’oxydes. De manière très logique, le nombre de degrés d’oxydation que peut adopter un métal de transition augmente avec le nombre d’électrons non appariés de sa bande de valence (de gauche à droite dans le tableau de classification) puis diminue à partir du moment où les électrons commencent à s’apparier.
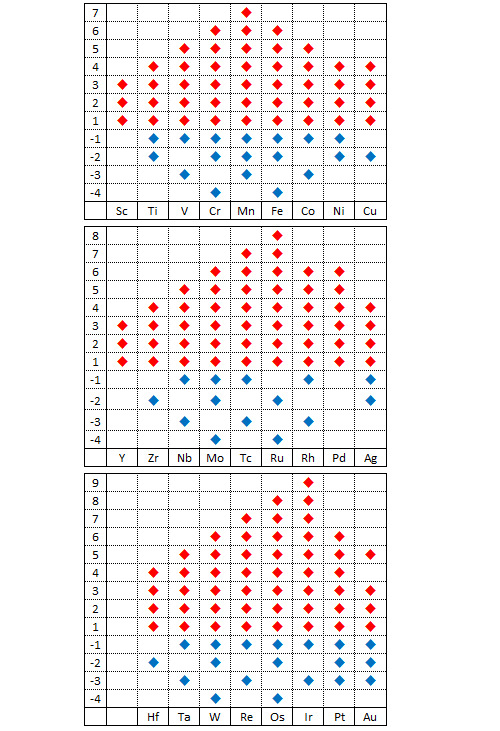
Le tableau qui précède récapitule les différents degrés d’oxydation possibles pour les métaux de transition. Le champion toutes catégories est l’iridium Ir : un tetraoxyde d’iridium IrO4+ a été synthétisé récemment dans lequel il présente un degré d’oxydation +9. Les degrés d’oxydation observés dans la nature sont moins nombreux et l’ion permanganate MnO4- (+7) est l’un des composés métalliques courants avec le degré d’oxydation le plus fort. Le permanganate de potassium est un décapant et un décolorant. Il a été utilisé pendant la guerre comme carburant.
Il existe de nombreux composés métalliques avec un degré d’oxydation zéro (en particulier les composés métal carbonyle comme le pentacarbonyle de fer Fe(CO)5 ou le tetracarbonyle de nickel Ni(CO)4). Les carbonyles de métal sont très utilisés comme catalyseurs ou comme précurseurs en chimie organique. Les degrés d’oxydation négatifs se rencontrent principalement dans les composés organométalliques. C’est le cas par exemple dans l’ion hexacarbonyle de vanadium [V(CO)6]-.
Parmi les métaux de transition, on classe à part les métaux dits nobles compte tenu de leur résistance à la corrosion. Cette famille regroupe l’or Au, l’argent Ag ainsi que tous les métaux platinoïdes à l’exception du rhénium Re. Ces métaux peuvent exister sous forme oxydée mais leur potentiel d’oxydo-réduction positif et relativement élevé rend cette oxydation rare. L’éclat pratiquement inaltérable de l’or en a fait un matériau très prisé dans pratiquement toutes les civilisations.
Composés complexes
Les métaux de transition sont particulièrement intéressants du fait de leur capacité à se coordonner avec des ligands pour former des composés complexes. La chimie des composés complexes est particulièrement riche. Une série de posts lui est consacrée. Les complexes organométalliques jouent un grand rôle en chimie organique : de façon naturelle (dans la chlorophylle, l’hémoglobine et certaines vitamines par exemple) ou artificielle (comme médicaments ou au titre de catalyseurs dans la chimie de synthèse).
Pour en savoir plus :
post sur le tableau de classification des éléments
post sur la nucléosynthèse
post sur le noyau des atomes
post sur l’oxydoréduction
post sur le degré d’oxydation
post sur les liaisons chimiques
post sur les complexes
post sur les complexes (approche covalente)
post sur les propriétés magnétiques
post sur le fer
post sur le haut-fourneau
index
#chimie#métal#métal de transition#métaux#fer#cuivre#chrome#platine#palladium#rhodium#catalyse#catalyseur#oxydoréduction#complexe#organométallique#liaison métallique#valence#coordination#iridium#vanadium#métal carbonyle#manganèse#métal noble#conductivité
0 notes
Text
Métaux alcalins et alcalino-terreux
Métaux alcalins
On donne le nom de métaux alcalins aux éléments de la première colonne du tableau périodique des éléments en dehors de l’hydrogène. Ces éléments sont le lithium Li, le sodium Na, le potassium K, le rubidium Rb, le césium Cs et le Francium Fr. Ils ont tous la particularité de n’avoir qu’un seul électron dans leur bande de valence. De fait, ils sont tous très peu électronégatifs, beaucoup moins que l’hydrogène par exemple dont le potentiel d’électronégativité est égal à 2,2. Ils sont nucléophiles (donneurs d’électron). Le francium est un élément radioactif de durée de vie égale à 21 minutes.
Le sodium, le potassium et le fluor sont des oligoéléments. Is sont respectivement en 9è, 7è et 13è position dans la liste des éléments les plus abondants du corps humain. Dans la croûte terrestre, le sodium et le potassium pointent en 6è et 7è place (28000 et 26000 ppm). En revanche, ils sont peu abondants l’univers, le lithium ne représentant que 2,3 10-6 de la masse baryonique et le sodium 1 10-6.
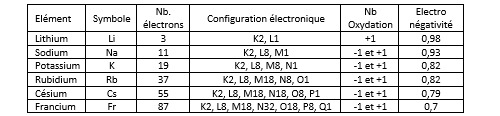
Dans les conditions normales de température et de pression, si l’on excepte le francium qui fond à 20°, ils se présentent sous la forme d’un métal plutôt mou (on peut le couper avec un couteau). Ils s’oxydent très vite à l’air libre, perdant ainsi l’aspect brillant que leur confère leur caractère métallique. Ils sont relativement léger : la densité des trois premiers (Li, Na, K) est inférieure à 1, celle des trois autres inférieure à deux. Leur point de fusion s’étage entre 20° pour le francium et 97,8° pour le sodium. Seul le lithium reste solide jusqu’à 180°. Leur point d’ébullition est supérieur à 650°, celui du lithium atteint 1342°.
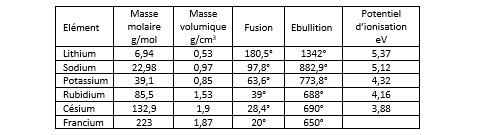
Le potentiel de première ionisation des métaux alcalins est relativement faible : de 3,88 eV pour le césium à 5,37 eV pour le lithium. Ils s’ionisent donc facilement pour donner les cations Li+, Na+, K+, Rb+ et Cs+. Ceci explique leur caractère nucléophile. Il est beaucoup plus difficile de leur arracher un deuxième électron (27 eV pour le césium, 47 eV pour le sodium). Il faut en effet aller chercher cet électron sur la couche n-1 qui est complète, donc très stable.
Le potentiel d’oxydoréduction du lithium est élevé, ce qui en fait un composant très recherché pour réaliser des piles (piles au lithium).
Hydroxyde
Les métaux alcaline réagissent violemment avec l’eau en dégageant de l’hydrogène qui brûle dans l’air et peut même provoquer une explosion :

L’hydroxyde de sodium NaOH est plus connu sous le nom de soude caustique. La soude caustique se présente sous forme de cristaux. Elle est très hygroscopique. En solution, elle libère l’ion OH- qui est une base forte. Elle est utilisée de manière intensive, en particulier pour ses propriétés de détergent. L’hydroxyde de potassium KOH porte le nom de potasse. Il est utilisé en industrie chimique pour produire des engrais ou du savon.
La lithine LiOH est moins connue, c’est une base forte très corrosive. En présence de peroxyde d’hydrogène, l’hydroxyde de lithium forme un composé ionique appelé hydroperoxyde de lithium LiOOH :
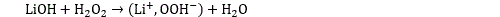
Hydrures
Les métaux alcalins réagissent avec l’hydrogène pour former des hydrures :

Les hydrures de métaux alcalins sont des bases fortes qui libèrent des ions OH- en solution dans l’eau.
Oxydes
Les métaux alcalins s’oxydent rapidement pour donner des oxydes, des peroxydes ou des superoxydes :
Li2O, Li2O2
Na2O, Na2O2, NaO2
K2O, K2O2, KO2
Cs2O, Cs4O
Ces oxydes sont en général basiques et réagissent avec l’eau pour donner des hydroxydes. Les peroxydes et superoxydes ont tendance à redonner naturellement des oxydes et de l’oxygène.
La bande de valence du soufre a la même configuration que celle de l’oxygène, il réagit avec les métaux alcalins pour donner des sulfures (sulfure de sodium Na2S, sulfure de potassium K2S). Ces sulfures s’hydrolysent complètement pour donner des hydroxydes :

L’ion SH- a des propriétés très proches de celles de l’ion OH-.
Halogénures
Nucléophiles, les métaux alcalins sont attaqués par les halogènes pour former des halogénures. Le chlorure de sodium NaCl et le chlorure d potassium KCl sont bien sûr connus pour leur utilisation culinaire. Le chlorure de lithium LiCl est utilisé dans l’industrie chimique et sidérurgique. Les fluorures (LiF, NaF, KF) sont toxiques. Ils sont utilisés dans l’industrie. L’iodure de potassium KI a de nombreuses applications en chimie organique, dans l’alimentation mais aussi dans l’industrie pharmaceutique.
Sels d’oxacides
Du fait de leur caractère nucléophile les métaux alcalins forment des sels avec tous les oxacides. Des nitrates et des nitrites tout d’abord. Si le nitrate de sodium NaNO3 et le nitrate de lithium LiNO3 ont un emploi limité, le nitrate de potassium KNO3, plus connu sous le nom de salpêtre, a longtemps été utilisé comme ingrédient principal pour faire de la poudre à canon. Il continue d’être utilisé comme propergol ou en charcuterie. Le nitrite de sodium NaNO2 a lui aussi des applications alimentaires ainsi que dans l’industrie chimique.
Le carbonate de potassium K2CO3 est utilisé comme engrais et pour ses propriétés fongicides. Il rentre également dans la composition du verre. Le carbonate de sodium Na2CO3 (appelé improprement cristaux de soude) a de nombreuses applications (savon, sidérurgie…). Le bicarbonate de soude (Na+CO2OH-) et le bicarbonate de potassium (K+CO2OH-) ont des usages multiples, y compris domestiques comme régulateur de pH. Ce sont des hydrogénocarbonates. On les prépare en faisant réagir le carbonate correspondant avec de l’eau et du dioxyde de carbone :

Le carbonate de lithium Li2CO3 a quelques applications industrielles.
Le sulfate de sodium Na2SO4 est produit industriellement pour l’industrie du verre ou celle des textiles. Ses propriétés de détergent sont également appréciées. Le sulfate de potassium K2SO4, que l’on trouve dans les plantes, est un engrais. Il est aussi utilisé comme composant dans les peintures. Le sulfite de sodium Na2SO3 est un additif alimentaire aux vertus antioxydantes. Le thiosulfate Na2S2O3 est un ligand. Il est utilisé comme fixateur en photographie mais également comme antidote pour neutraliser l’effet de certains produits toxiques.
Le phosphate de sodium Na3PO4 est un additif alimentaire, tout comme le dihydrogénophosphate de potassium KH2PO4. L’hydrogénophosphate de potassium K2HPO4 est utilisé comme régulateur d’acidité de l’estomac et dans l’agriculture biologique.
On ne peut pas terminer ce tour d’horizon des sels alcalins sans parler du permanganate de potassium KMnO4. Connu pour ses vertus de désinfectant, il est aussi utilisé dans la conservation des fruits (il arrête le processus de mûrissement en oxydant l’éthylène dégagé par les fruits) et le traitement de eaux. C’est aussi un composant intervenant dans la fabrication de certains ergols. permanganate de calcium CaMnO4. C’est un agent blanchissant que l’on trouve dans la composition de nombreux dentifrices.
Métaux alcalino-terreux
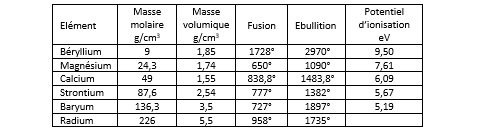
Les métaux alcalino-terreux sont les éléments de la deuxième colonne. Ces éléments sont le béryllium Be, le magnésium Mg, le calcium Ca, le strontium Sr, le baryum Ba et le radium Ra. Le radium est radioactif. La demi-vie du 226Ra est de 1600 ans. Leur caractéristique commune est de posséder deux électrons dans leur bande de valence.
Le magnésium est relativement abondant dans l’Univers (0,06%). Il se classe à la 9ème position à l’échelle de la voie lactée. La calcium figure dans la liste des 20 premiers (0,007%). Les autres éléments sont beaucoup plus rares. Le magnésium et le calcium sont les seuls métaux alcalino-terreux relativement abondants dans la croûte terrestre : 2,9% pour le magnésium et 5% pour le calcium. Le calcium est un outre un oligoélément qui représente 1,4% de la masse du corps humain (en particulier dans le squelette).
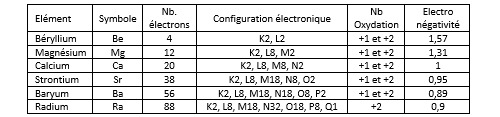
Dans les conditions normales de température et de pression ils se présentent sous forme cristalline. Si l’on excepte le béryllium, le point de fusion des métaux alcalino-terreux est inférieur à 1000°C. Le béryllium, le magnésium et le calcium (et même le strontium) sont peu denses.
Comme les métaux alcalins ils sont peu électronégatifs. Si l’on excepte le béryllium qui noue généralement des liaisons covalentes, Ils donnent facilement des cations chargés deux fois positivement : Mg2+, Ca2+...
Oxydes
Les oxydes des métaux alcalino-terreux (BeO, MgO, CaO, SrO, BaO) sont des oxydes cristallins de couleur blanche. Ils sont obtenus par combustion du métal dans le dioxygène, par calcination d’un sel, carbonate ou nitrate, ou par déshydratation d’un hydroxyde. Leur température de fusion est très élevée (supérieure à 2500°C pour l’es oxydes de béryllium, de magnésium et de calcium). L’oxyde de calcium est appelé communément chaux vive.
Halogénures
Les métaux alcalino-terreux sont très réactifs avec les halogènes. Si l’on excepte le béryllium, ils forment des sels ioniques qui s’hydrolysent dans l’eau. Les halogénures de béryllium (comme le chlorure de béryllium BeCl2) sont quant à eux covalents et ne réagissent pas avec l’eau.
Hydroxydes
Le magnésium, le calcium, le strontium et le baryum forment des hydroxydes qui sont des bases fortes :

L’hydroxyde de calcium est appelé chaux éteinte. Le béryllium ne réagit pas avec l’eau.
Sels d’oxacides
Magnésium, calcium, strontium et baryum forment aisément des sels d’oxacides (carbonate, nitrate, phosphate, sulfate) et c’est en général sous cette forme qu’on les trouve dans la nature. Le carbonate de calcium CaCO3 par exemple est le composant de base du calcaire et le gypse est un sulfate de calcium hydraté CaSO4.2H2O. Le béryllium fait une nouvelle fois exception du fait de sa faible propension à former de tels composés.
Composés organomagnésiens
Les composés organomagnésiens sont des molécules organiques dans laquelle il y a au moins une liaison carbone-magnésium. Parmi les composés organomagnésiens on distingue une sous-famille appelée réactifs de Grignard de formule générique R-MgX, R étant une molécule organique et X un halogène.
Les composés organomagnésiens jouent un rôle important en chimie organique et notamment en synthèse organique. Les réactifs de Grignard permettent en particulier de réaliser des substitutions nucléophiles et des additions nucléophiles.
Applications
La magnésium est utilisé en mécanique sous forme d’alliage avec l’aluminium (le magnésium est inflammable et est rarement utilisé seul). Il est aussi utilisé en chimie organique (voir ci-dessus). Le calcium est utilisé pour ses propriétés réductrices dans le traitement du minerai ainsi que dans la production du plâtre et du ciment. En tant qu’oligoéléments, le magnésium et le calcium sont utilisés comme composants dans des produits pharmaceutiques et parapharmaceutiques. Le béryllium a des applications militaires (rigidité et stabilité sur une large gamme de température). L’oxyde de béryllium qui est à la fois isolant et conducteur thermique a des applications en microélectronique. Les autres métaux alcalino-terreux ont beaucoup moins d’applications.
Rôle dans la chimie du vivant
Le calcium et le magnésium jouent un rôle essentiel dans la chimie du vivant. L’hydroxyapatite Ca5(PO4)3(OH)2 est le composant minéral qui donne leur solidité aux os et aux dents. Le carbonate de calcium forme la coquille des mollusques. Calcium et magnésium sont aussi des oligoéléments. Le magnésium en particulier est un cofacteur de nombreuses enzymes.
Pour en savoir plus :
post sur le tableau périodique des éléments
post sur l’électronégativité
post sur les espèces nucléophiles et électrophiles
post sur les acides et les bases
post sur les sels
post sur les halogènes
post sur le calcium
post sur le mégnésium
index
#chimie#minéraux#alcalin#sodium#potassium#lithium#hydrure#hydroxyde#acide#électronégativité#nucléophile#rubidium#césium#sel#nitrate#phosphate#oxyde#oxydoréduction
0 notes
Text
Les halogènes
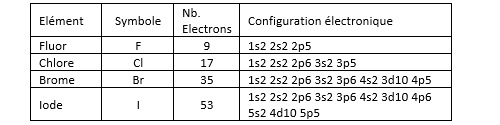
On donne le nom d’halogène aux groupe d’éléments chimiques qui constituent l’avant dernière colonne du tableau périodique des éléments (colonne XVII) : fluor F, chlore Cl, brome Br, iode I, astate At et tennessee Ts. Les quatre premiers éléments de ce groupe ont des propriétés chimiques proches et constitue une famille au sens chimique du terme. L’astate quant à lui est plutôt classé dans la famille des métalloïdes. Le tennessee n’existe pas à l’état naturel (il est produit de manière synthétique) et il est radioactif.
Les membres de la famille des halogènes ont en commun le fait qu’il leur manque un électron pour que leur couche de valence soit saturée.
Cette configuration leur confère un fort caractère électronégatif et en fait des éléments très réactifs. Le fluor, par exemple, réagit avec tous les éléments chimiques connus, depuis le fluorure d’hydrogène HF jusqu’à l’hexafluorure d’uranium UF6, en passant par le difluorure d’oxygène OF2, le trifluorure de chlore ClF3 (un interhalogène), l’hexafluorure de soufre SF6, le fluorure de fer (III) FeF3 ou le fluorure d’aluminium AlF3 (des halogénures métalliques). Il intervient dans de nombreux composés comme le trihydrate de fluorure ferrique de formule FeF3.3H2O, des complexes comme le [FeF4][XeF5], des hydrofluorocarbures (HFC) comme le difluorométhane CH2F2 ou des chlorofluorocarbures (CFC) comme le dichlorodifluorométhane CCl2F2…
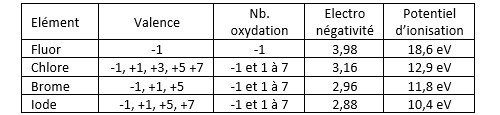
Les halogènes sont des oxydants puissants (le fluor oxyde l’oxygène !). Ils sont électrophiles et participent de ce fait à des réactions d’addition ou de substitution. Ils forment des acides binaires ou des oxacides… Les dérivés halogénés sont multiples. Leur potentiel d’ionisation (énergie nécessaire pour arracher un électron) est élevé. Le cation halogène est un animal rare…
Forme moléculaire
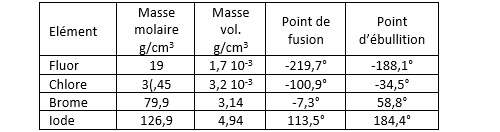
Les halogènes se présentent sous forme diatomique : F2, Cl2, Br2 et I2. Dans les conditions normales de température et de pression, le difluor et le dichlore sont à l’état gazeux, le dibrome est un liquide dense de couleur brune et le diiode un solide noirâtre.
Halogénures d’hydrogène
Les halogénures d’hydrogène sont des acides binaires. Ce sont des acides forts et toxiques. Le chlorure d’hydrogène HCl (acide chlorhydrique) et le fluorure d’hydrogène HF (acide fluorhydrique) sont produits et utilisés de manière industrielle. Le bromure d’hydrogène HBr et l’iodure d’hydrogène HI ont un emploi plus limité.
Halogénures de métaux
Les halogènes réagissent avec les éléments alcalins, alcalinoterreux et les métaux en général. On connait bien-sûr le chlorure de sodium NaCl, il existe aussi du fluorure de sodium NaF, du bromure de sodium NaBr et de l’iodure de sodium NaI.
Le calcium est un alcalinoterreux, il forme des halogénures avec tous les halogènes : fluorure de calcium CaF2 (aussi appelé fluorine), chlorure de calcium CaCl2, bromure de calcium CaBr2, iodure de calcium CaI2. Le chlorure de calcium s’obtient par exemple en faisant réagir de l’acide chlorhydrique avec de carbonate de calcium :
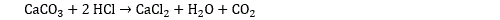
Le fer est l’élément emblématique de la famille des métaux de transition. Il est attaqué par le fluor, le chlore, le brome et l’iode et donne des halogénures de fer (II) ou de fer (III) : FeF3, FeCl3, FeCl2, FeBr3, FeI2… L’acide chlorhydrique sous sa forme solvatée est utilisé industriellement pour décaper les oxydes de fer :
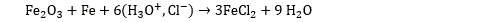
… et de non métaux
Il existe des halogénures de métalloïdes comme le pentafluorure d’antimoine SbF5, qui est un acide de Lewis fort. On trouve également des halogénures d’éléments non métalliques comme le trifluorure d’azote NF3, le trichlorure d’azote NCl3 ou l’hexafluorure de soufre SF6.
En réagissant avec des bases de Lewis, les acides halogénohydriques donnent des composés comme le fluorure d’ammonium NH4F ou le chlorure d’ammonium NH4Cl.

Le fluor forme par exemple du fluorure de tétraméthylammonium N(CH3)4F avec l’ion N(CH3)4+ par nature pourtant peu réactif.
Le fluor, décidément très réactif, réagit avec le xénon, pourtant un gaz noble, pour donner du tétrafluorure de xénon XeF4. Tétrafluorure de xénon et fluorure de tétraméthylammonium réagissent ensemble pour former du pentafluoroxénate de tétraméthylammonium N(CH3)4XeF5. Il existe également un hexafluorure de xénon XeF6, plus actif encore que le tétrafluorure (on dit que c’est un agent fluorant). En présence de fluorure de fer (III) FeF3, il forme un composé complexe de formule [FeF4][XeF5].
Interhalogène
Le fluor réagit avec le chlore, le brome et l’iode pour donner des fluorures d’halogène : ClF, ClF3 et ClF5 ; BrF, BrF3 et BrF5 ; IF, IF3 ,IF5 et IF7.

Le chlore réagit avec le brome et l’iode : BrCl, ICl. Le brome réagit avec l’iode : IBr.
Oxydes
Il existe de nombreux oxydes d’halogène ou halogénures d’oxygène. On connait 3 fluorures d’oxygène (difluorure d’oxygène OF2, difluorure de dioxygène O2F2, difluorure de trioxygène O3F2). Le difluorure d’oxygène s’obtient par exemple en faisant interagir du difluor avec de la soude :
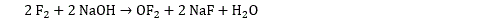
Il existe une douzaine d’oxydes de chlore, depuis l’oxyde de chlore ClO jusqu’à l’oxyperoxyde de chlore (VII) (OClO3)2, en passant par le trioxyde de chlore ClO3 ou le tétroxyde de dichlore ClOClO3.
Les oxydes de fluor peuvent former des liaisons avec d’autres halogènes et donner des composés comme le FClO, le FClO2 ou le F3ClO2. Ce type de composé est une forme particulière d’oxohalogénure. Un oxohalogénure est un composé dont la formule générique est AOnXm, A étant un élément quelconque et X un halogène. Le trichlorure de phosphoryle P(=O)Cl3 est un oxohalogénure, tout comme le fluorure de sulfuryle S(=O)2F2. Le trichlorure de phosphoryle s’obtient par oxydation du trichlorure de phosphore :

Oxacides et sels d’oxacide
Il n’existe pas d’oxacides à base de fluor. Il en existe par contre un certain nombre à base de chlore, de brome et d’iode :
acide hypochloreux HOCl, acide chloreux HClO2, acide chlorique HClO3, acide perchlorique HClO4
acide hypobromeux HOBr, acide bromeux HBrO2, acide bromique HBrO3, acide perbromique HBrO4
acide hypoiodeux HOI, acide iodique HIO3, acide periodique HIO4

Ce sont des acides plus ou moins forts et plus ou moins stables. L’acide perbromique par exemple est un acide fort mais instable alors que l’acide chloreux, lui aussi instable, est un acide faible. Les bases conjuguées de ces acides (hypochlorite ClO-, chlorite ClO2-, chlorate ClO3-, hypobromite BrO-, bromite BrO2-, bromate BrO3-) participent à de nombreux sels.
Chimie organique
Les halogènes réagissent avec de nombreuses molécules organiques dans des réactions de substitution, d’oxydation ou des réactions acide-base.
Un halogénoalcane, aussi appelé halogénure d’alkyle, est un alcane dont un ou plusieurs atomes d’hydrogène est (sont) substitué(s) par un ou plusieurs atomes d’halogène (fluorométhane CH3F, chloroéthane C2H5Cl, bromoéthane C2H5Br, difuoroéthane C2H4F2). Les hydrofluorocarbures (HFC) forment une sous-famille des halogénoalcanes. Ce sont des halogénoalcanes dans lesquels seule une partie des atomes d’hydrogène a été remplacée par des atomes de fluor. Ils sont moins nocifs pour l’environnement que les chlorofluorocarbures (CFC), des halogénoalcanes dans lesquels tous les atomes d’hydrogène ont été remplacés par des atomes de fluor ou de chlore. Le fréon, très utilisé dans l’industrie du froid, par exemple, est un dichlorodifluorométhane CCl2F2. Le dichlorotétrafluoroéthane C2Cl2F4 est également utilisé dans les compresseurs réfrigérants.
Les halogénoalcanes sont utilisés pour effectuer des réactions d’alkylation qui permettent l’ajout d’un groupement alkyle à une molécule organique :
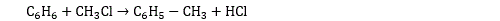
Le tristement célèbre gaz moutarde, aussi appelé ypérite, est un dérivé chloré du sulfure de diéthyle, un thioéther dont la formule est (C2H5)2S (formule développée CH3-CH2-S-CH2-CH3). L’ypérite est obtenu par halogénation du sulfure de diéthyle à ses deux extrémités. Sa formule est (C2H4Cl)2S.
Nota : un thioéther est un éther-oxyde dans lequel l’atome d’oxygène est remplacé par un atome de soufre.
Il existe également des halogénoalcènes. Les halogénures d’allyle (formule générique H2C=CH-CH2X) sont obtenus par substitution d’un atome d’hydrogène du propène. Le chlorure de vinyle H2C=CHCl (chloroéthène) est surtout connu parce que c’est le monomère du PVC, le polychlorure de vinyle.
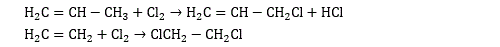
Un halogénure d’acyle est un halogénure d’acide carboxylique (formule générique R-C(=O)X). Son nom est obtenu en remplaçant la terminaison -oïque de l’acide par la terminaison -oyle. On peut citer par exemple le fluorure de propanoyle H3C-CH2-C(=O)F ou le chlorure de benzoyle C6H5-C(=O)Cl.
Il existe également de nombreux halogénures aromatiques, comme le fluorure de benzyle C6H5-CH2F (aussi appelé fluorométhylbenzène) ou encore le bromobenzaldéhyde Br-C6H4-C(=O)H.
Pour en savoir plus :
post sur la classification périodique des éléments
post sur les acides et les bases
post sur l’oxydoréduction
post sur l’électronégativité
post sur les espèces nucléophiles et électrophiles
post sur les métaux alcalins
post sur les hydrocarbures
index
#chimie#halogène#fluor#chlore#brome#iode#halogénure#acide#électronégativité#électronégatif#valence#oxydoréduction
0 notes
Text
Oxydoréduction
Une oxydoréduction est une réaction au cours de laquelle il se produit un transfert d’électrons. On dit de l’élément (ou du composé) qui donne un ou plusieurs électrons qu’il est oxydé et de l’élément ou du composé qui accepte ce(s) électron(s) qu’il est réduit. Un élément ou un composé qui a une forte propension à accepter (voire à chiper) des électrons est un oxydant. L’élément ou le composé donneur est appelé réducteur. Ces deux éléments forment un couple redox.
Le rôle des électrons dans les liaisons chimiques
Il existe différents types de liaisons chimiques (voir les posts à ce sujet). Nous allons nous intéresser à deux d’entre eux : la liaison covalente et la liaison ionique. Dans la liaison covalente, chaque élément met en commun un électron. L’orbitale des deux électrons mis en commun est étendue à la molécule tout entière, ce qui assure la stabilité de la liaison. Dans la liaison ionique, l’un des éléments du composé chimique capte l’un des électrons de l’autre élément et la liaison qui se forme est de nature électrostatique entre un cation et un anion. La différence entre ces deux types de liaison n’est cependant pas aussi tranchée qu’il y paraît. Dans le cas de la liaison covalente, l’un des éléments va souvent « tirer la couverture à lui ». En clair, cela signifie que l’orbitale électronique des électrons engagés dans la liaison ne sera pas répartie de manière symétrique entre les deux éléments. La probabilité de trouver ces électrons est plus forte près de l’un des deux éléments que de l’autre. Dans ce cas, la liaison covalente est donc partiellement ionique. C’est le cas de l’eau (H20) mais également, par exemple, du dioxyde de carbone (CO2) ou de l’ammoniac (NH3).
Oxydation et réduction
Lorsqu’Antoine Lavoisier établit au XVIIIème les premières définitions des réactions d’oxydation et de réduction, les notions d’atome, d’électron et de liaison covalente n’étaient pas connues. Pour Lavoisier, l’oxydation était la combinaison d’un élément avec l’oxygène et la réduction l’extraction d’un élément à partir d’un oxyde :

On a remarqué plus tard la similitude de certaines réactions avec les réactions d’oxydation et de réduction telles que les avait définies Lavoisier. Ainsi par exemple :

La tentation était grande de dire que le chlore oxyde le cuivre. Tout comme on peut dire que l’hydrogène réduit l’azote dans la réaction qui produit l’ammoniac.
Potentiel d’oxydoréduction
La nature « électrique » des phénomènes intervenant dans les réactions d’oxydoréduction est clairement apparue lorsque les premières piles électriques ont été mises au point : d’abord en 1800 par Alessandro Volta puis en 1836 par John Daniell. La pile Daniell est la première avoir été utilisée de manière industrielle. Elle comporte deux compartiments. Chaque compartiment contient un couple redox. Un coupe redox est constitué d’un oxydant et de sa forme réduite. Dans le cas de la pile Daniell, le compartiment relié au pôle négatif (anode) contient une lame de zinc dans une solution de sulfate de zinc et le compartiment relié au pôle positif (cathode) une lame de cuivre dans une solution de sulfate de cuivre. Les deux compartiments sont reliés chimiquement par un pont salin contenant une solution de chlorure de potassium KCl ou de nitrate de potassium KNO3. Lorsque les deux pôles sont reliés à un circuit électrique extérieur, il apparaît une différence de potentiel entre le pôle plus (la cathode) et le pôle moins (l’anode) qui permet la circulation d’un courant. Le processus générateur de courant peut être décomposé sous la forme de deux demi-réactions :

Le courant qui circule s’accompagne d’une réaction d’oxydation du zinc et de réduction du sulfate de cuivre : il y a croissance de la lame de cuivre et dégradation de la lame de zinc (voir le post sur les piles alcalines).
Il faudra attendre le début du XXème siècle pour que l’on comprenne de façon plus précise le rôle des électrons dans les réactions d’oxydoréduction mais on n’a pas attendu cette date pour établir une échelle de potentiel d’oxydoréduction. Le potentiel d’oxydoréduction est une grandeur empirique, exprimée en Volt, obtenue en mesurant le potentiel électrique d’une pile composée du couple redox dont on veut mesurer le potentiel et d’un couple redox de référence, en l’occurrence le couple H+/H2. Ce couple est aussi appelé électrode normale à hydrogène (ENH). Lorsque le courant circule depuis l’électrode plongée dans le couple à mesurer vers l’ENH le potentiel est positif et il est négatif dans le cas contraire. Autrement dit, lorsque ce potentiel, noté E0, est positif, le couple a un caractère plutôt oxydant et lorsqu’il est négatif, il a un caractère plutôt réducteur.
Réaction d’oxydoréduction et couple redox
Sur cette base, on peut dire qu’une réaction d’oxydoréduction est une réaction qui fait intervenir deux couples redox (Oxy1, Red1) et (Oxy2, Red2) :

Dans cette réaction, le transfert d’électrons se fait de l’élément Red2 vers l’élément Oxy1. Comme on l’a fait dans le cas de la pile Daniell, on peut décomposer cette réaction en deux demi-réactions :

En termes de potentiels d’oxydoréduction, cette réaction est rendue possible parce qu’il existe une différence de potentiel redox favorable :

Si on reprend l’exemple de la pile Daniell, le potentiel du couple (Zn++/Zn) est négatif et il vaut -0,76 V. Le potentiel du couple (Cu++/Cu) est quant à lui positif et il vaut 0,34 V. Si on verse une solution de sulfate de cuivre dans un tube à essai contenant la poudre de zinc, la solution initialement bleutée devint incolore et il apparait une poudre orangée caractéristique de la présence de poudre de cuivre :

Le tube chauffe de manière significative (la réaction est exothermique). Une différence de potentiel redox positive entraîne, la plupart du temps, une réaction spontanée d’oxydoréduction. Prenons l’exemple de l’oxydation du fer par l’oxygène :

Les couples redox intervenant dans cette réaction sont :
(O2/O2-) dont le potentiel redox est 1,12 V,
(Fe3+/Fe) dont le potentiel redox est -0,04 V.
On vérifie bien que la différence de potentiel redox est positive, ce qui correspond à une oxydation spontanée du fer par le dioxygène. Nous avons dit en début de ce post que le chlore se comportait la plupart du temps comme un oxydant. Le potentiel redox du couple (Cl2/Cl-) est en effet de 1,36 V, il est donc a priori encore plus oxydant que l’oxygène :
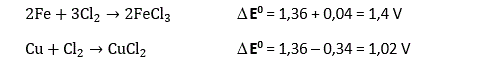
En toute rigueur, le terme E0 doit être corrigé en fonction de différents paramètres qui tiennent compte de l’environnement et de la concentration en éléments chimiques en utilisant une formule appelée équation de Nernst :

R étant la constante des gaz parfaits, F la constante de Faraday et les termes aox et ared pouvant être approximés par les valeurs de concentration des éléments considérés. L’équation de Nernst permet en particulier d’établir les conditions dans lesquelles il y a équilibre entre les deux membres de la réaction. Walther Nernst est un physicien et chimiste allemand qui vécut entre 1864 et 1941.
Couples redox
Les chimistes ont établi des listes de couples redox avec leur potentiel d’oxydoréduction. Il en existe une très grande variété et nous n’en donnerons ici que quelques exemples :

Et cetera… A chacun de ces couples, nous l’avons dit, est associé un potentiel soigneusement consigné dans ces listes. On trouvera ci-dessous une liste non exhaustive de potentiels standards :

Pour en savoir plus :
post d’introduction à la chimie
post sur les éléments chimiques
post sur les liaisons chimiques
post sur le degré d’oxydation
post sur le haut-fourneau
post sur la cohésion de la matière
post sur les piles alcalines
post sur les acides et les base
glossaire de chimie générale
post sur la classification périodique des éléments
index
#oxydation#réduction#Oxydoréduction#redox#chimie#oxygène#hydrogène#pile alcaline#daniell#volta#lavoisier#potentiel#cuivre#zinc#oxyde#hydroxyde#acide#sel#hydracide#oxacide#nernst
0 notes
Text
Acides et bases
La définition la plus commune des acides a été proposée en 1923 par Nicolaus Brönsted. Pour Brönsted, un acide est un composé chimique capable de libérer un proton H+ pour donner une base. La définition de Bronsted reprend et généralise une définition plus restrictive proposée à la fin du XIXème siècle par Svante Arrhénius. Dans son acception la plus courante, un couple acide-base est noté AH/A- :

Remarque : le proton H+ se rencontre rarement seul. Il est le plus souvent solvaté, par exemple sous la forme d’un ion hydronium H3O+.
On dit de A- que c’est la base conjuguée de l’acide AH. L’acide chlorhydrique HCl et l’acide sulfurique H2SO4 en sont les exemples les plus emblématiques. L’acide chlorhydrique est un composé gazeux soluble. Sa base conjuguée est l’ion Cl-. L’acide sulfurique existe lui sous forme liquide. Sa base conjuguée est l’ion Sulfate SO42-. Dans le cas de ces deux acides, la libération de proton se fait par dissociation. Elle peut également se faire par décomposition dans l’eau. On note ces couples sous la forme B+/BOH :

La notion de base est, d’une certaine manière, définie en miroir de celle d’acide. Une base est une espèce capable de capter un proton pour donner un acide. On rencontre souvent dans la littérature une définition différente de cette notion. Elle alors présentée comme une substance chimique capable de libérer des ions hydroxyde OH- :

Cette définition qui renvoie à la formulation d’Arrhénius est plus restrictive puisqu’elle ne s’applique qu’en solution aqueuse. Elle s’applique bien à certains composés comme les hydroxydes. L’hydroxyde de sodium NaOH par exemple, un solide blanc plus connu sous le nom de soude, est une base dont la forme acide conjuguée est l’ion Na+. Elle ne s’applique pas à l’ammoniac NH3 qui est tout à fait capable de capturer un proton en dehors de tout contexte humide :

La molécule NH3, qui est polaire, attire le proton faiblement lié au chlore dans le chlorure d’hydrogène pour former un ion NH4+ qui attire à son tour l’ion Cl- (ammoniac et chlorure d’hydrogène sont à l’état gazeux). Il se forme à l’issue de la réaction un brouillard blanchâtre constitué de fines particules de chlorure d’ammonium. L’ammoniac est donc bien une base au sens de Bronsted tout en échappant à la formulation d’Arrhénius.
L’eau a un statut particulier. L’eau peut aussi bien jouer le rôle d’un acide que d’une base. On dit que c’est un ampholyte (l’adjectif associé est amphotère). L’eau est capable de perdre un proton pour donner l’ion hydroxyde HO¯ et peut aussi gagner un proton pour former l'ion hydronium H3O+. L’eau est donc un acide dans le couple H2O/HO¯ et une base dans le couple H3O+/H2O.
Acide et base de Lewis
Le chimiste Gilbert Lewis a donné une définition différente de la notion d’acide et de base. Une base de Lewis est un composé chimique donneur d’un doublet d’électrons et qui possède donc un tel doublet électronique non liant libre dans sa bande de valence. Un acide de Lewis est un composé chimique accepteur de doublet électronique. Un acide de Lewis est donc un composé chimique qui présente structurellement une orbitale vide.
Prenons le cas du borane BH3. Le bore possède 5 électrons : deux sur sa couche n = 1 et 3 sur sa couche n = 2 (répartis sur les sous-couches l = 0 et 1). Ces trois électrons sont engagés dans les liaisons avec les atomes d’hydrogène et les trois doublets ainsi constitués occupent trois des orbitales de la couche n = 2. Or il y a 4 orbitales possibles sur cette couche. Il en résulte que le borane dispose d’une orbitale libre et peut accepter un doublet supplémentaire. C’est donc un acide de Lewis. Même cas de figure pour le chlorure d’aluminium AlCl3 ou le fluorure d’aluminium AlF3. L’aluminium possède 13 électrons, 2 sur sa couche n = 1 et 8 sur sa couche n = 2, qui sont toutes deux saturées. Il reste 3 électrons sur sa couche de valence, répartis sur les sous-couches l = 0 et l = 1. Ces trois électrons sont engagés dans les liaisons avec les atomes de chlore ou de fluore, ce qui fait trois doublets occupant trois des orbitales des sous-couches l = 0 et l = 1 qui peuvent en comporter 4. Le chlorure d’aluminium et le fluorure d’aluminium sont également des acides de Lewis.
L’azote de son côté possède 7 électrons, deux sur sa couche n = 1 et 5 sur sa couche n = 2. Dans la molécule d’ammoniac NH3, 3 de ces électrons sont engagés dans les liaisons avec les atomes d’hydrogène, formant ainsi ce que l’on appelle des doublets liants. Les deux derniers électrons constituent un doublet non liant qui fait de l’ammoniac une base de Lewis. En présence d’un catalyseur, l’ammoniac réagit avec la borane pour donner du borazane :

La définition de Lewis recouvre celle de Bronsted : un proton H+ n’est-il pas l’acide de Lewis le plus élémentaire ? L’inverse n’est pas nécessairement vrai.
Nota : le test du pH (voir plus bas) ne s’applique pas aux acides de Lewis. Cependant, l'introduction d'un acide de Lewis dans l'eau conduit la plupart du temps à une diminution de son pH.
Acide fort, acide faible et pH
Nous avons souligné plus haut le fait que les acides se dissociaient dans les solvants, transformant le solvant en un acide :

On dit d’un acide qu’il est fort lorsqu’une telle réaction est complète et rapide. Dans ce cas le composé AH n’existe pas en solution car il est entièrement dissocié. Lorsque la réaction conduit à un équilibre entre les deux membres de la réaction, on a affaire à un acide faible. On définit de la même façon la notion de base forte ou faible en fonction de la rapidité et de la complétude de la dissociation de celle-ci dans un solvant.
Cette notion de force des acides et des bases se mesure à l’échelle du pH (potentiel hydrogène) de la solution :

aH étant l’activité des ions hydrogène H+. L’activité est assimilable, en première approximation, à la concentration en ion hydronium H3O+. Le pH varie entre 0 et 14. Un acide fort très peu dilué à un pH faible, voire égal à zéro. Une base forte très peu diluée a un pH voisin ou égal à 14. Une solution de pH égal à 7 est neutre.
Différents types d’acide
En chimie minérale, on distingue deux classes d’acides : les hydracides et les oxacides. Les hydracides (qu’on appelle aussi acides binaires) sont composés d’un non-métal associé à un ou plusieurs atomes d’hydrogène. Leur formule générique est HX. Il existe deux façons de les nommer. Soit <X-nom> le nom du non-métal considéré :
On peut les nommer en faisant suivre <X-nom> par le suffixe -ure et en ajoutant la mention « d’hydrogène ». Exemples : chlorure d’hydrogène HCl, sulfure d’hydrogène H2S.
On peut aussi les nommer en formant un adjectif avec <X-nom> suivi du suffixe -hydrique. On utilise cette dénomination de préférence lorsque l’acide considéré est en solution aqueuse. Exemples : acide chlorhydrique HCl, acide sulfhydrique H2S.
L’acide cyanhydrique HCN (cyanure d’hydrogène) n’est pas, stricto sensu, un acide binaire mais il en a toutes les caractéristiques : le carbone et l’azote sont tous deux des non-métaux et ils sont liés par une triple liaison covalente très forte.
L’anion libéré par un hydracide en solution porte le nom du non-métal suivi du suffixe -ure : ion chlorure Cl-, ion sulfure S2-, ion cyanure CN-.
Les oxacides (ou oxoacides) ont pour formule générique HXO. L’élément noté X est le plus souvent un non-métal mais il existe des oxacides à base de métal fortement oxydé (acide manganique HMnO4 par exemple). L’élément associé à l’hydrogène dans un oxacide peut être oxydé à différents degrés. On connaît par exemple plusieurs types d’oxacides sulfuriques : l’acide sulfureux H2SO3, l’acide sulfurique H2SO4 et l’acide peroxydisulfurique H2S2O8. La règle doit donc tenir compte du nombre d’oxydation de l’élément oxydé. Le nombre d’oxydation est le nombre de charges électriques (réelles dans le cas d’une liaison ionique, fictive dans le cas d’une liaison covalente) portées par l’élément à la base de l’oxacide. Dans le cas général, le nombre d’oxydation est égal à 1 ou 2. La règle est alors :
de les nommer en faisant suivre <X-nom> par le suffixe -ate ou -ite et en ajoutant la mention « d’hydrogène ». Exemples : nitrite d’hydrogène HNO2, nitrate d’hydrogène HNO3 ;
de les nommer en formant un adjectif avec <X-nom> suivi du suffixe -ique ou -eux. On utilise cette dénomination de préférence lorsque l’acide considéré est en solution aqueuse. Exemples : acide nitreux HNO2, acide nitrique HNO3.
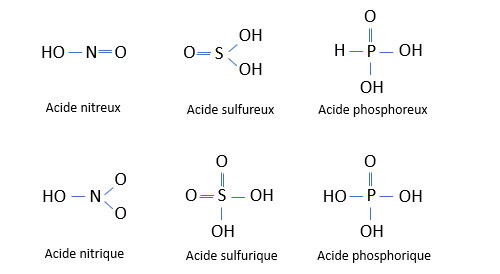
Comme on le voit dans la figure qui précède, les oxacides sont porteurs de groupes OH. On a pourtant dit en début de ce post que la présence de ce groupe pouvait caractériser une base. Alors qu’est-ce qui différencie la soude NaOH de de l’acide nitrique NO2OH ou de l’acide sulfurique SO2(OH)2 ? A l’état solide la soude est un cristal ionique. Cela signifie que ce cristal est formé de cations Na+ et d’anions OH- maintenus ensemble par des liaisons ioniques. En solution dans l’eau, anions et cations se dissocient. Dans un oxacide la liaison entre l’atome d’oxygène du ou des groupe(s) OH et le minéral est covalente. La dissociation se fait entre l’atome d’oxygène et l’atome d’hydrogène.
Remarque : il existe une troisième catégorie de composés présentant un ou des groupes OH, les alcools. Ils sont généralement amphotères.
En chimie organique, les acides carboxyliques jouent un rôle central (voir le post à ce sujet). Un acide carboxylique est un acide porteur du groupe -COOH. A première vue, la présence du groupe -OH peut paraître surprenante pour un acide. L'acidité des acides carboxyliques s'explique par l’effet inductif de la liaison C=O qui est très polarisée, ce qui fait que le carbone attire les électrons de l'autre atome d’oxygène. Le groupe -OH étant lui aussi polarisé, l'électron de l'atome d’hydrogène est attiré par le carbone « électrophile ». La liaison de l’hydrogène avec le reste de la molécule est donc essentiellement ionique et l’ion H+ peut en être dissocié assez facilement.
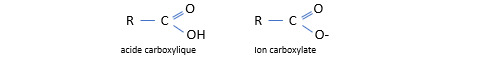
Pour obtenir le nom d’un acide carboxylique, on ajoute le suffixe -oïque au nom de l’hydrocarbure qui constitue l’ossature de sa chaîne carbonée .
HCOOH : acide méthanoïque (aussi appelé acide formique)
CH3-CH2-COOH : acide propanoïque
C6H5-COOH : acide benzoïque
Le nom de l’ion carboxylate correspondant est obtenu en remplaçant le suffixe -oïque par le suffixe -oate. Par exemple, l’ion HCOO- est l’ion méthanoate.
Un acide aminé est acide carboxylique possédant également un groupe amine.
Propriétés des acides
Les acides et les bases sont en général très réactifs. Il convient cependant de faire la distinction entre les réactions acido-basiques et les réactions d’oxydoréduction dans lesquelles des acides (ou des bases) peuvent intervenir. Dans une réaction acido-basique, les réactifs échangent un proton (acide de Brönsted) ou un doublet électronique (acide de Lewis) et le nombre d’oxydoréduction des substances en présence reste inchangé. A contrario, dans une oxydoréduction les réactifs échangent un électron et leur nombre d’oxydation évolue.
Réaction acide/base
La réaction acide/base typique s’écrit comme suit :
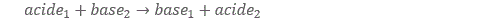
La caractéristique de la réaction acide/base est le transfert de protons. L’acide 1 cède un proton à la base 2 qui le capte et les rôles sont inversés à l’issue de la réaction. La configuration finale est plus stable que la configuration d’origine. On dit qu’il y a eu neutralisation. Le plus souvent, la réaction produit au final un composé peu réactif auquel on a donné le nom de sel, par extension du nom de sel donné au composé chimique NaCl bien connu des cuisiniers/ères.
Reprenons à titre d’exemple l’équation ci-dessus avec une solution de chlorure d’ammonium NH4Cl et de soude NaOH. Il se produit dans cette solution une réaction acide/base dont l’équation est la suivante :

Le transfert de proton apparaît clairement si on décompose cette réaction en deux demi-équations :

La production d’ammoniac se traduit par un dégagement gazeux. L’ion chlorure Cl- et l’ion Na+ quant à eux n’interviennent pas dans ces réactions. Par contre, ils laissent un résidu solide composé de cristaux de chlorure de sodium NaCl après évaporation de l’eau.
Remarque : dans cet exemple, c’est le couple (H2O/OH-) qui intervient dans la deuxième demi-réaction. C’est l’eau en tant que base qui joue le rôle d’accepteur de proton. On dit de l’eau que c’est un solvant protique. Un solvant protique est une solvant capable de céder ou de capter un proton. L’ammoniac, le méthanol ou l’acide sulfurique sont également des solvants protiques.
Comme on l’a vu, une réaction acido-basique conduit souvent à la formation d’un sel mais ce n’est pas systématique. C’est en général le cas lorsqu’on fait réagir un acide et un hydroxyde :

Dans l’exemple cité au début de ce post (réaction de l’ammoniac gazeux avec du chlorure d’hydrogène) on aboutissait également à la production d’un sel, le chlorure d’ammonium bien que l’ammoniac ne soit pas un hydroxyde :

Complexation
Une réaction de complexation est une réaction qui fait intervenir un acide de Lewis avec une base de Lewis. Ce type de réaction se traduit par l’échange d’un doublet d’électron. L’ion Ag+ comme de nombreux cations métalliques, est un acide de Lewis et l’ammoniac est, comme on l’a vu, une base de Lewis. La réaction de l’ion Ag+ avec de l’ammoniac en solution est une réaction de complexation :

Le produit de cette réaction est l’ion diamine argent. Un tel composé est appelé complexe : il associe une base de Lewis et un acide de Lexis.
Oxydoréduction
Les acides peuvent réagir avec les métaux et les oxyder. Ce type de réaction est d’ailleurs une source de corrosion majeure. Dans ce type de réaction, il n’y a pas à proprement parler de transfert de proton. C’est un transfert d’électrons qui se produit, transfert qui est la caractéristique d’une réaction d’oxydoréduction.
Acides non oxydants : l’acide chlorhydrique HCl et l’acide sulfurique H2SO4
Ces deux acides sont des acides forts totalement dissociés mais leur anion (Cl- ou SO42-) n’a pas un potentiel d’oxydation élevé. C’est la raison pour laquelle on les classe dans la catégorie des acides non oxydants. La réaction d’oxydoréduction fait intervenir l'ion hydronium H3O+. C’est cet ion hydronium qui récupère les électrons libérés par les métaux considérés. Ce type de réaction ne se produit qu’avec des métaux très réducteurs comme le fer et le zinc. La réaction se traduit par un dégagement de dihydrogène et la formation d’ions Fe2+ ou Zn2+. Ils n’ont par contre pas d’effet sur des métaux peu réducteurs comme le cuivre ou l’argent. Si on prend l’exemple du fer, l’action du chlorure d’hydrogène se traduit comme suit :

L’ion fer se combine ensuite aux anions chlore pour former du chlorure de fer. On obtient certes l’équation résultante suivante :

mais cette équation est, d’une certaine manière trompeuse. Le dégagement d’hydrogène n’est pas le résultat d’une réaction acide/base mais bien d’une réduction de l’hydrogène libéré par le chlorure d’hydrogène. L’action de l’acide sulfurique sur le magnésium peut s’interprète de la même façon :

Un acide oxydant, l’acide nitrique
L'acide nitrique est un oxydant puissant qui peut oxyder les métaux nobles tels que le cuivre et l’argent. Cette propriété est due cette fois à l'ion nitrate NO3-. L'ion H3O+ n’intervient pas. Lorsqu’on verse de l’acide nitrique sur du zinc par exemple, il y a production d’une abondante vapeur de NO2 à la place du dihydrogène. L'oxydant est donc bien l'anion NO3- dont le nombre d’oxydation est diminué au cours de la réaction. Même chose avec de la poudre d’argent. La présence d’ions argent Ag+ est mise en évidence en diluant dans l’eau le produit obtenu et le faisant précipiter avec du chlorure de sodium (formation de chlorure d'argent).
Cas particulier : l’acide carboxylique
Les acides carboxyliques sont des acides faibles. Ils se dissocient partiellement dans l’eau (pH voisin de 5) :

La chimie des acides carboxylique est riche. Elle est présentée plus en détails dans le post consacré à de type d’acide.
Pour en savoir plus :
post d’introduction à la chimie
post sur les composants élémentaires
pst sur les électrons dans les liaisons covalentes
post sur les liaisons chimiques
post sur les ligands et la complexation
post sur l’oxydoréduction
post sur l’acide carboxylique
post sur l’eau
post sur les sels
post sur les métaux alcalins
post sur la classification périodique des éléments
glossaire de chimie générale
index
#chimie#acide#hydracide#oxacide#hydronium#arrhenius#bronsted#lewis#oxydation#réduction#oxydoréduction#redox#carboxylique#chlorhydrique#sulfurique#nitrique#ph#complexation
0 notes
Text
Le feu
La maîtrise du feu a joué un rôle de premier plan dans l’histoire de l’humanité. Le feu a profondément transformé le régime alimentaire des premiers humains et a, sur le long terme, modifié leur morphologie. C’est aussi autour du feu que s’est développée la sociabilité. Et c’est encore de la maîtrise du feu que sont nées la fabrication de la céramique et celle d’outils et d’armes métalliques. Mais qu’est-ce qu’une flamme ?
La combustion
La flamme résulte d’une réaction exothermique de combustion. La combustion est une réaction d’oxydo-réduction. Pour qu’il y ait combustion, il faut que trois éléments soient réunis :
un combustible, le matériau qui sera oxydé,
un comburant, l’élément oxydant, généralement du dioxygène gazeux,
un apport de chaleur initial (on parle d’énergie d’activation).
Le combustible est le plus souvent un végétal ou un hydrocarbure mais cela peut aussi être un métal ou un sel. Il peut se trouver sous forme solide, liquide ou gazeuse. L’apport de chaleur peut être de faible durée (une simple étincelle peut suffire). Le dégagement de chaleur de la combustion entretient ensuite la réaction.
Structure d’une flamme
Si le combustible se présente initialement sous diverses formes, la réaction de combustion se produit toujours entre deux gaz. C’est là qu’intervient l’apport de chaleur. Cet apport de chaleur décompose le combustible en différents éléments dont certains sont volatils. Cette décomposition peut être le produit d’une distillation ou d’une pyrolyse. Elle intervient dès lors que l’on dépasse le point éclair, c’est-à-dire la température à laquelle un combustible émet des vapeurs qui peuvent s’enflammer lorsqu’elles sont mélangées à l’air ambiant.
Une fois la combustion démarrée, la flamme va pouvoir se développer. A la base, la couleur de la flamme est monochrome. Elle résulte d’un phénomène de luminescence. La réaction d’oxydoréduction se traduit par un saut quantique des électrons au sein des molécules de gaz qui se combinent. Dans le cas d’une bougie, d’une allumette ou d’un morceau de bois, cette couleur est bleue et elle est due à la production de CO2. D’autres éléments donnent d’autres couleurs : jaune pour le sodium, vert pour le baryum... De quoi satisfaire tous les amateurs de feu d’artifice.
Nota : dans le cas d’une bougie, la chaleur fait fondre la cire (de la stéarine) qui monte le long de la mèche avant de se vaporiser.
Au-dessus de cette zone de combustion (en général une couche assez mince), s’élèvent du fait de la poussée d’Archimède les produits de la combustion et les gaz imbrûlés très chauds. Cette colonne qui monte est pauvre en oxygène et la combustion ne peut plus s’y produire. Les molécules qui s’y trouvent se combinent pour former de la suie. Les particules de suie chauffées à plus de 1500°C sont incandescentes. Elles émettent un rayonnement de type corps noir. Il est presque blanc à la limite de la zone de combustion puis tire vers le jaune orangé à mesure que la flamme monte et se refroidit.
Le mouvement ascendant du gaz dans la flamme crée un mouvement de convection : l’air est aspiré à la base de celle-ci et entretient la combustion, donc la chaleur.
Flamme de prémélange
La belle couleur jaune orangé de la flamme est due à la présence de gaz imbrûlés et de suie. Dans le brûleur d’une gazinière ou en sortie d’un chalumeau, le mélange est réglé de façon à ce que la combustion soit complète. C’est pour cela que la flamme d’une gazinière est bleue.
Pour en savoir plus :
post sur l’oxydo-réduction
post sur les corps noirs
post sur le nuage électronique
post sur la luminescence et l’incandescence
index
#feu#chimie#flamme#oxydation#Oxydoréduction#température#couleur#corps noir#luminescence#incandescence#suie#chandelle#lumière
0 notes