#oxoacid
Text
Acids composed of hydrogen, oxygen and some other element are called I do oxoacids (see table 11.8).

"Chemistry" 2e - Blackman, A., Bottle, S., Schmid, S., Mocerino, M., Wille, U.
#book quotes#chemistry#nonfiction#textbook#oxoacid#acid#hydrogen#oxygen#carbonic acid#nitric acid#nitrous acid#phosphoric acid#phosphorus acid#arsenous acid#sulfuric acid#sulfurous acid#selenic acid#selenous acid#hypofluorous acid#perchloric acid#chloric acid#chlorous acid#hypochlorous acid#perbromic acid#bromic acid#hypobromous acid#periodic acid#hypoiodous acid#iodic acid
0 notes
Video
youtube
50L 100PPM HOCL generator machine for hospital/dental clinic/fruit preservation disinfection operation
Hypochlorous acid is a chlorine oxoacid with formula HOCl; a weak, unstable acid, it is the active form of chlorine in water.
Welcome to contact me:
www.labequipmachine.com
https://moreshine.en.alibaba.com
Email: [email protected]
https://wa.me/+8618075169174
#Hypochlorousacid
#HOCL
0 notes
Text
Get Precise Insights into Your Liver Health with PACE Hospitals' SGPT Test in Hyderabad
Your liver plays a vital role in your overall health, performing numerous functions like detoxification, protein synthesis, and blood sugar regulation. Monitoring its health is crucial for early detection of potential problems. The SGPT test in Hyderabad, also known as the ALT (alanine aminotransferase) test, is a simple blood test offered by PACE Hospitals that measures the level of an enzyme present in the liver. Elevated SGPT levels can indicate liver damage or disease.

What is SGOT and SGPT ?
SGPT stands for Serum Glutamate Oxaloacetate Transaminase (SGOT) and SGPT stands for Serum Glutamate Pyruvate Transaminase (SGPT) are the two liver enzymes called aminotransferases or transaminases. These liver enzymes are necessary for converting oxoacids and amino acids by transfer of amino groups.
SGPT and SGOT are obsolete (old) names. While SGPT is now currently termed as Alanine Aminotransferase (ALT), SGOT is termed as Aspartate Aminotransferase (AST).
The SGOT and SGPT normal range is.
Alanine transaminase (SGPT or ALT): 4 to 36 IU/L
Aspartate transaminase (SGOT or AST): 5 to 30 IU/L
Benefits of Getting an SGPT Test at PACE Hospitals:
Accurate and Reliable Results: PACE Hospitals utilizes state-of-the-art equipment and adheres to stringent quality control measures to ensure the accuracy of your test results.
Expert Guidance: Our team of experienced healthcare professionals can interpret your test results and provide personalized recommendations based on your specific needs.
Proactive Management: Early detection of liver issues allows for timely intervention and treatment, potentially preventing complications.
Convenience and Comfort: Schedule your SGPT test appointment online or by calling our dedicated team. Our patient-centric approach ensures a smooth and comfortable experience.
Who Should Consider an SGPT Test?
An SGPT test may be recommended for individuals with:
A history of liver disease, such as hepatitis
Symptoms of liver problems, including fatigue, nausea, abdominal pain, or jaundice
Certain medical conditions like diabetes or high cholesterol
Individuals who consume excess alcohol
Take Charge of Your Liver Health Today
PACE Hospitals is committed to providing comprehensive and advanced diagnostic services to empower you to make informed decisions about your well-being.
Don't wait to prioritize your liver health. Take the first step towards optimal well-being with PACE Hospitals' SGPT test.
0 notes
Text
@hqrbinger "what is a halogen" ok, i get it, i chemistry more than the average person, but what Σ(ಠ_ಠ)
#hqrbinger#dango's singular braincell#not genshin#bestie if u though u could escape the harassment u have been mistaken#its...#didnt u have a basic chem class in 7th grade?#ok i understand u didnt have the whole thing going on too but?????#halogens???????#its a group of elements?????????#and to answer my question#yes they form oxoacids which are. well. acidic
16 notes
·
View notes
Text
18/6/2021

2/21 DOP ✨
I have been studying Chemical bonding for the last 6 hours , I am exhausted and have reached my saturation. I answered a mock exam as well today ! I'm glad that I gave time to this chapter cause it carries heavy weightage in NEET.
I also solved PYQs on this chapter .
I wrote down all the structures which are important in this chapter , because I found it difficult to memorize them , plan is to write down and practice them everyday.
If anyone wants the sheets I made with the structures you can DM me :) it has Structures of all compounds from the chapter in NCERT and some additional compounds , structures of oxoacids of sulphur and phosphorus.
I'll be doing Biology next . Then , Kinematics .
All in all I am exhausted and will be taking a break now :)
I think I will be pulling an all nighter today .
P.S: I studied for 12 hours yesterday !
Adios
🙏
#studtblr#stdyblr#studyblr#study motivation#study hard#study blog#study space#studyinspo#study aesthetic#aesthetic#aesthetics#productive#productivity#neet2021#neetexam#neetpreparation#neetphysics#med school#pre med
29 notes
·
View notes
Photo

July 6 Day#1 of #21toimprove for #neet2020 . I swear my mind is stuck on June. . Early post cause need to work uninterrupted in the next few hours. . Productive Time: ~6 hrs Way below the benchmark. But more than my usual average. . Also, it's totally CHEATING when they label it as Chemical Bonding topic, and ask, which of the following Sulphur oxoacids have peroxide bond? Are you kidding me? That's p16 Question, dumbass. . Instagram: 1.5 hrs. Chatting with a variety of people mostly. This is why I joined this community. I love talking. I love listening even more. I love making people laugh the most.😋 (Yesterday: 4.5 hrs. Can you believe it?) . +Nominated by @someonestudiesmed (that oh my gosh! Feeling when a (possible/hopeful) senior tags you😜) for #chargeyoursoul✨ -An abstract art, basically playing with sketch pens and pencil colours on a very moist, very bad Classmate paper. Heavily edited, since my camera ain't no shit. -Quote credit: The Fault in Our Stars (John Green) . Sup with you guys? Tag me when you update yo! Signing off. . Arnab #aiimsdelhi https://www.instagram.com/p/CCTMxBAh1cX/?igshid=ynv96df35usd
1 note
·
View note
Text
Did key building blocks for life come from deep space?
All living beings need cells and energy to replicate. Without these fundamental building blocks, living organisms on Earth would not be able to reproduce and would simply not exist.

Little was known about a key element in the building blocks, phosphates, until now. University of Hawaii at Manoa researchers, in collaboration with colleagues in France and Taiwan, provide compelling new evidence that this component for life was found to be generated in outer space and delivered to Earth in its first one billion years by meteorites or comets. The phosphorus compounds were then incorporated in biomolecules found in cells in living beings on Earth.
The breakthrough research is outlined in "An Interstellar Synthesis of Phosphorus Oxoacids," authored by UH Manoa graduate student Andrew Turner, now the assistant professor at the University of Pikeville, and UH Manoa chemistry Professor Ralf Kaiser in the September issue of Nature Communications.
According to the study, phosphates and diphosphoric acid are two major elements that are essential for these building blocks in molecular biology. They are the main constituents of chromosomes, the carriers of genetic information in which DNA is found. Together with phospholipids in cell membranes and adenosine triphosphate, which function as energy carriers in cells, they form self-replicating material present in all living organisms.
In an ultra-high vacuum chamber cooled down to 5 K (-450°F) in the W.M. Keck Research Laboratory in Astrochemistry at UH Manoa, the Hawaii team replicated interstellar icy grains coated with carbon dioxide and water, which are ubiquitous in cold molecular clouds, and phosphine. When exposed to ionizing radiation in the form of high-energy electrons to simulate the cosmic rays in space, multiple phosphorus oxoacids like phosphoric acid and diphosphoric acid were synthesized via non-equilibrium reactions.
"On Earth, phosphine is lethal to living beings," said Turner, lead author. "But in the interstellar medium, an exotic phosphine chemistry can promote rare chemical reaction pathways to initiate the formation of biorelevant molecules such as oxoacids of phosphorus, which eventually might spark the molecular evolution of life as we know it."
Kaiser added, "The phosphorus oxoacids detected in our experiments by combination of sophisticated analytics involving lasers, coupled to mass spectrometers along with gas chromatographs, might have also been formed within the ices of comets such as 67P/Churyumov-Gerasimenko, which contains a phosphorus source believed to derive from phosphine." Kaiser says these techniques can also be used to detect trace amounts of explosives and drugs.
"Since comets contain at least partially the remnants of the material of the protoplanetary disk that formed our solar system, these compounds might be traced back to the interstellar medium wherever sufficient phosphine in interstellar ices is available," said Cornelia Meinert of the University of Nice (France).
Upon delivery to Earth by meteorites or comets, these phosphorus oxoacids might have been available for Earth's prebiotic phosphorus chemistry. Hence an understanding of the facile synthesis of these oxoacids is essential to untangle the origin of water-soluble prebiotic phosphorus compounds and how they might have been incorporated into organisms not only on Earth, but potentially in our universe as well.
Turner and Kaiser worked with Meinert and Agnes Chang of National Dong Hwa University (Taiwan) on this project.
27 notes
·
View notes
Text
NCERT Solutions for Class 12 Chemistry Chapter 7 The p Block Elements
myTechMint.
NCERT Solutions for Class 12 Chemistry Chapter 7 The p Block Elements
Topics and Subtopics in NCERT Solutions for Class 12 Chemistry Chapter 7 The p Block Elements: Section Name Topic Name Section Name Topic Name 7 The p-Block Elements 7.12 Simple Oxides 7.1 Group 15 Elements 7.13 Ozone 7.2 Dinitrogen 7.14 Sulphur – Allotropic Forms 7.3 Ammonia 7.15 Sulphur Dioxide 7.4 Oxides of Nitrogen 7.16 Oxoacids of …
NCERT Solutions for Class 12 Chemistry Chapter 7 The p Block Elements
Asha
Source: https://www.mytechmint.com/ncert-solutions-for-class-12-chemistry-chapter-7-the-p-block-elements/
myTechMint - Get Tech News, Learn Online Technical Tutorials, Free Job Alert, Competitive Exam Preparation Study Materials, Download B.Tech and CBSE (NCERT) Notes.
0 notes
Photo

Différence entre -ate et en -ite en chimie : la nomenclature des acides Les acides qui contiennent de l’oxygène et de l’hydrogène sont appelés oxacides, oxyacides, oxoacides ou encore acides ternaires.
0 notes
Note
what are you learning in chem
ionic compounds, acids, oxoacids/oxyacids, uhhhhh naming acids, hold on its easier if i show
1 note
·
View note
Text
hey science side of tumblr
how do you write the name and formula for an oxoacid when only given an element with one charge
1 note
·
View note
Text
Acides et bases
La définition la plus commune des acides a été proposée en 1923 par Nicolaus Brönsted. Pour Brönsted, un acide est un composé chimique capable de libérer un proton H+ pour donner une base. La définition de Bronsted reprend et généralise une définition plus restrictive proposée à la fin du XIXème siècle par Svante Arrhénius. Dans son acception la plus courante, un couple acide-base est noté AH/A- :

Remarque : le proton H+ se rencontre rarement seul. Il est le plus souvent solvaté, par exemple sous la forme d’un ion hydronium H3O+.
On dit de A- que c’est la base conjuguée de l’acide AH. L’acide chlorhydrique HCl et l’acide sulfurique H2SO4 en sont les exemples les plus emblématiques. L’acide chlorhydrique est un composé gazeux soluble. Sa base conjuguée est l’ion Cl-. L’acide sulfurique existe lui sous forme liquide. Sa base conjuguée est l’ion Sulfate SO42-. Dans le cas de ces deux acides, la libération de proton se fait par dissociation. Elle peut également se faire par décomposition dans l’eau. On note ces couples sous la forme B+/BOH :

La notion de base est, d’une certaine manière, définie en miroir de celle d’acide. Une base est une espèce capable de capter un proton pour donner un acide. On rencontre souvent dans la littérature une définition différente de cette notion. Elle alors présentée comme une substance chimique capable de libérer des ions hydroxyde OH- :

Cette définition qui renvoie à la formulation d’Arrhénius est plus restrictive puisqu’elle ne s’applique qu’en solution aqueuse. Elle s’applique bien à certains composés comme les hydroxydes. L’hydroxyde de sodium NaOH par exemple, un solide blanc plus connu sous le nom de soude, est une base dont la forme acide conjuguée est l’ion Na+. Elle ne s’applique pas à l’ammoniac NH3 qui est tout à fait capable de capturer un proton en dehors de tout contexte humide :

La molécule NH3, qui est polaire, attire le proton faiblement lié au chlore dans le chlorure d’hydrogène pour former un ion NH4+ qui attire à son tour l’ion Cl- (ammoniac et chlorure d’hydrogène sont à l’état gazeux). Il se forme à l’issue de la réaction un brouillard blanchâtre constitué de fines particules de chlorure d’ammonium. L’ammoniac est donc bien une base au sens de Bronsted tout en échappant à la formulation d’Arrhénius.
L’eau a un statut particulier. L’eau peut aussi bien jouer le rôle d’un acide que d’une base. On dit que c’est un ampholyte (l’adjectif associé est amphotère). L’eau est capable de perdre un proton pour donner l’ion hydroxyde HO¯ et peut aussi gagner un proton pour former l'ion hydronium H3O+. L’eau est donc un acide dans le couple H2O/HO¯ et une base dans le couple H3O+/H2O.
Acide et base de Lewis
Le chimiste Gilbert Lewis a donné une définition différente de la notion d’acide et de base. Une base de Lewis est un composé chimique donneur d’un doublet d’électrons et qui possède donc un tel doublet électronique non liant libre dans sa bande de valence. Un acide de Lewis est un composé chimique accepteur de doublet électronique. Un acide de Lewis est donc un composé chimique qui présente structurellement une orbitale vide.
Prenons le cas du borane BH3. Le bore possède 5 électrons : deux sur sa couche n = 1 et 3 sur sa couche n = 2 (répartis sur les sous-couches l = 0 et 1). Ces trois électrons sont engagés dans les liaisons avec les atomes d’hydrogène et les trois doublets ainsi constitués occupent trois des orbitales de la couche n = 2. Or il y a 4 orbitales possibles sur cette couche. Il en résulte que le borane dispose d’une orbitale libre et peut accepter un doublet supplémentaire. C’est donc un acide de Lewis. Même cas de figure pour le chlorure d’aluminium AlCl3 ou le fluorure d’aluminium AlF3. L’aluminium possède 13 électrons, 2 sur sa couche n = 1 et 8 sur sa couche n = 2, qui sont toutes deux saturées. Il reste 3 électrons sur sa couche de valence, répartis sur les sous-couches l = 0 et l = 1. Ces trois électrons sont engagés dans les liaisons avec les atomes de chlore ou de fluore, ce qui fait trois doublets occupant trois des orbitales des sous-couches l = 0 et l = 1 qui peuvent en comporter 4. Le chlorure d’aluminium et le fluorure d’aluminium sont également des acides de Lewis.
L’azote de son côté possède 7 électrons, deux sur sa couche n = 1 et 5 sur sa couche n = 2. Dans la molécule d’ammoniac NH3, 3 de ces électrons sont engagés dans les liaisons avec les atomes d’hydrogène, formant ainsi ce que l’on appelle des doublets liants. Les deux derniers électrons constituent un doublet non liant qui fait de l’ammoniac une base de Lewis. En présence d’un catalyseur, l’ammoniac réagit avec la borane pour donner du borazane :

La définition de Lewis recouvre celle de Bronsted : un proton H+ n’est-il pas l’acide de Lewis le plus élémentaire ? L’inverse n’est pas nécessairement vrai.
Nota : le test du pH (voir plus bas) ne s’applique pas aux acides de Lewis. Cependant, l'introduction d'un acide de Lewis dans l'eau conduit la plupart du temps à une diminution de son pH.
Acide fort, acide faible et pH
Nous avons souligné plus haut le fait que les acides se dissociaient dans les solvants, transformant le solvant en un acide :

On dit d’un acide qu’il est fort lorsqu’une telle réaction est complète et rapide. Dans ce cas le composé AH n’existe pas en solution car il est entièrement dissocié. Lorsque la réaction conduit à un équilibre entre les deux membres de la réaction, on a affaire à un acide faible. On définit de la même façon la notion de base forte ou faible en fonction de la rapidité et de la complétude de la dissociation de celle-ci dans un solvant.
Cette notion de force des acides et des bases se mesure à l’échelle du pH (potentiel hydrogène) de la solution :

aH étant l’activité des ions hydrogène H+. L’activité est assimilable, en première approximation, à la concentration en ion hydronium H3O+. Le pH varie entre 0 et 14. Un acide fort très peu dilué à un pH faible, voire égal à zéro. Une base forte très peu diluée a un pH voisin ou égal à 14. Une solution de pH égal à 7 est neutre.
Différents types d’acide
En chimie minérale, on distingue deux classes d’acides : les hydracides et les oxacides. Les hydracides (qu’on appelle aussi acides binaires) sont composés d’un non-métal associé à un ou plusieurs atomes d’hydrogène. Leur formule générique est HX. Il existe deux façons de les nommer. Soit <X-nom> le nom du non-métal considéré :
On peut les nommer en faisant suivre <X-nom> par le suffixe -ure et en ajoutant la mention « d’hydrogène ». Exemples : chlorure d’hydrogène HCl, sulfure d’hydrogène H2S.
On peut aussi les nommer en formant un adjectif avec <X-nom> suivi du suffixe -hydrique. On utilise cette dénomination de préférence lorsque l’acide considéré est en solution aqueuse. Exemples : acide chlorhydrique HCl, acide sulfhydrique H2S.
L’acide cyanhydrique HCN (cyanure d’hydrogène) n’est pas, stricto sensu, un acide binaire mais il en a toutes les caractéristiques : le carbone et l’azote sont tous deux des non-métaux et ils sont liés par une triple liaison covalente très forte.
L’anion libéré par un hydracide en solution porte le nom du non-métal suivi du suffixe -ure : ion chlorure Cl-, ion sulfure S2-, ion cyanure CN-.
Les oxacides (ou oxoacides) ont pour formule générique HXO. L’élément noté X est le plus souvent un non-métal mais il existe des oxacides à base de métal fortement oxydé (acide manganique HMnO4 par exemple). L’élément associé à l’hydrogène dans un oxacide peut être oxydé à différents degrés. On connaît par exemple plusieurs types d’oxacides sulfuriques : l’acide sulfureux H2SO3, l’acide sulfurique H2SO4 et l’acide peroxydisulfurique H2S2O8. La règle doit donc tenir compte du nombre d’oxydation de l’élément oxydé. Le nombre d’oxydation est le nombre de charges électriques (réelles dans le cas d’une liaison ionique, fictive dans le cas d’une liaison covalente) portées par l’élément à la base de l’oxacide. Dans le cas général, le nombre d’oxydation est égal à 1 ou 2. La règle est alors :
de les nommer en faisant suivre <X-nom> par le suffixe -ate ou -ite et en ajoutant la mention « d’hydrogène ». Exemples : nitrite d’hydrogène HNO2, nitrate d’hydrogène HNO3 ;
de les nommer en formant un adjectif avec <X-nom> suivi du suffixe -ique ou -eux. On utilise cette dénomination de préférence lorsque l’acide considéré est en solution aqueuse. Exemples : acide nitreux HNO2, acide nitrique HNO3.
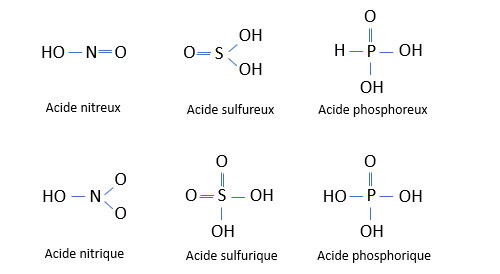
Comme on le voit dans la figure qui précède, les oxacides sont porteurs de groupes OH. On a pourtant dit en début de ce post que la présence de ce groupe pouvait caractériser une base. Alors qu’est-ce qui différencie la soude NaOH de de l’acide nitrique NO2OH ou de l’acide sulfurique SO2(OH)2 ? A l’état solide la soude est un cristal ionique. Cela signifie que ce cristal est formé de cations Na+ et d’anions OH- maintenus ensemble par des liaisons ioniques. En solution dans l’eau, anions et cations se dissocient. Dans un oxacide la liaison entre l’atome d’oxygène du ou des groupe(s) OH et le minéral est covalente. La dissociation se fait entre l’atome d’oxygène et l’atome d’hydrogène.
Remarque : il existe une troisième catégorie de composés présentant un ou des groupes OH, les alcools. Ils sont généralement amphotères.
En chimie organique, les acides carboxyliques jouent un rôle central (voir le post à ce sujet). Un acide carboxylique est un acide porteur du groupe -COOH. A première vue, la présence du groupe -OH peut paraître surprenante pour un acide. L'acidité des acides carboxyliques s'explique par l’effet inductif de la liaison C=O qui est très polarisée, ce qui fait que le carbone attire les électrons de l'autre atome d’oxygène. Le groupe -OH étant lui aussi polarisé, l'électron de l'atome d’hydrogène est attiré par le carbone « électrophile ». La liaison de l’hydrogène avec le reste de la molécule est donc essentiellement ionique et l’ion H+ peut en être dissocié assez facilement.
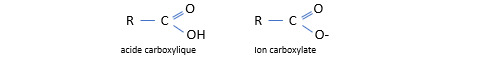
Pour obtenir le nom d’un acide carboxylique, on ajoute le suffixe -oïque au nom de l’hydrocarbure qui constitue l’ossature de sa chaîne carbonée .
HCOOH : acide méthanoïque (aussi appelé acide formique)
CH3-CH2-COOH : acide propanoïque
C6H5-COOH : acide benzoïque
Le nom de l’ion carboxylate correspondant est obtenu en remplaçant le suffixe -oïque par le suffixe -oate. Par exemple, l’ion HCOO- est l’ion méthanoate.
Un acide aminé est acide carboxylique possédant également un groupe amine.
Propriétés des acides
Les acides et les bases sont en général très réactifs. Il convient cependant de faire la distinction entre les réactions acido-basiques et les réactions d’oxydoréduction dans lesquelles des acides (ou des bases) peuvent intervenir. Dans une réaction acido-basique, les réactifs échangent un proton (acide de Brönsted) ou un doublet électronique (acide de Lewis) et le nombre d’oxydoréduction des substances en présence reste inchangé. A contrario, dans une oxydoréduction les réactifs échangent un électron et leur nombre d’oxydation évolue.
Réaction acide/base
La réaction acide/base typique s’écrit comme suit :
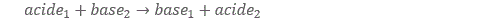
La caractéristique de la réaction acide/base est le transfert de protons. L’acide 1 cède un proton à la base 2 qui le capte et les rôles sont inversés à l’issue de la réaction. La configuration finale est plus stable que la configuration d’origine. On dit qu’il y a eu neutralisation. Le plus souvent, la réaction produit au final un composé peu réactif auquel on a donné le nom de sel, par extension du nom de sel donné au composé chimique NaCl bien connu des cuisiniers/ères.
Reprenons à titre d’exemple l’équation ci-dessus avec une solution de chlorure d’ammonium NH4Cl et de soude NaOH. Il se produit dans cette solution une réaction acide/base dont l’équation est la suivante :

Le transfert de proton apparaît clairement si on décompose cette réaction en deux demi-équations :

La production d’ammoniac se traduit par un dégagement gazeux. L’ion chlorure Cl- et l’ion Na+ quant à eux n’interviennent pas dans ces réactions. Par contre, ils laissent un résidu solide composé de cristaux de chlorure de sodium NaCl après évaporation de l’eau.
Remarque : dans cet exemple, c’est le couple (H2O/OH-) qui intervient dans la deuxième demi-réaction. C’est l’eau en tant que base qui joue le rôle d’accepteur de proton. On dit de l’eau que c’est un solvant protique. Un solvant protique est une solvant capable de céder ou de capter un proton. L’ammoniac, le méthanol ou l’acide sulfurique sont également des solvants protiques.
Comme on l’a vu, une réaction acido-basique conduit souvent à la formation d’un sel mais ce n’est pas systématique. C’est en général le cas lorsqu’on fait réagir un acide et un hydroxyde :

Dans l’exemple cité au début de ce post (réaction de l’ammoniac gazeux avec du chlorure d’hydrogène) on aboutissait également à la production d’un sel, le chlorure d’ammonium bien que l’ammoniac ne soit pas un hydroxyde :

Complexation
Une réaction de complexation est une réaction qui fait intervenir un acide de Lewis avec une base de Lewis. Ce type de réaction se traduit par l’échange d’un doublet d’électron. L’ion Ag+ comme de nombreux cations métalliques, est un acide de Lewis et l’ammoniac est, comme on l’a vu, une base de Lewis. La réaction de l’ion Ag+ avec de l’ammoniac en solution est une réaction de complexation :

Le produit de cette réaction est l’ion diamine argent. Un tel composé est appelé complexe : il associe une base de Lewis et un acide de Lexis.
Oxydoréduction
Les acides peuvent réagir avec les métaux et les oxyder. Ce type de réaction est d’ailleurs une source de corrosion majeure. Dans ce type de réaction, il n’y a pas à proprement parler de transfert de proton. C’est un transfert d’électrons qui se produit, transfert qui est la caractéristique d’une réaction d’oxydoréduction.
Acides non oxydants : l’acide chlorhydrique HCl et l’acide sulfurique H2SO4
Ces deux acides sont des acides forts totalement dissociés mais leur anion (Cl- ou SO42-) n’a pas un potentiel d’oxydation élevé. C’est la raison pour laquelle on les classe dans la catégorie des acides non oxydants. La réaction d’oxydoréduction fait intervenir l'ion hydronium H3O+. C’est cet ion hydronium qui récupère les électrons libérés par les métaux considérés. Ce type de réaction ne se produit qu’avec des métaux très réducteurs comme le fer et le zinc. La réaction se traduit par un dégagement de dihydrogène et la formation d’ions Fe2+ ou Zn2+. Ils n’ont par contre pas d’effet sur des métaux peu réducteurs comme le cuivre ou l’argent. Si on prend l’exemple du fer, l’action du chlorure d’hydrogène se traduit comme suit :

L’ion fer se combine ensuite aux anions chlore pour former du chlorure de fer. On obtient certes l’équation résultante suivante :

mais cette équation est, d’une certaine manière trompeuse. Le dégagement d’hydrogène n’est pas le résultat d’une réaction acide/base mais bien d’une réduction de l’hydrogène libéré par le chlorure d’hydrogène. L’action de l’acide sulfurique sur le magnésium peut s’interprète de la même façon :

Un acide oxydant, l’acide nitrique
L'acide nitrique est un oxydant puissant qui peut oxyder les métaux nobles tels que le cuivre et l’argent. Cette propriété est due cette fois à l'ion nitrate NO3-. L'ion H3O+ n’intervient pas. Lorsqu’on verse de l’acide nitrique sur du zinc par exemple, il y a production d’une abondante vapeur de NO2 à la place du dihydrogène. L'oxydant est donc bien l'anion NO3- dont le nombre d’oxydation est diminué au cours de la réaction. Même chose avec de la poudre d’argent. La présence d’ions argent Ag+ est mise en évidence en diluant dans l’eau le produit obtenu et le faisant précipiter avec du chlorure de sodium (formation de chlorure d'argent).
Cas particulier : l’acide carboxylique
Les acides carboxyliques sont des acides faibles. Ils se dissocient partiellement dans l’eau (pH voisin de 5) :

La chimie des acides carboxylique est riche. Elle est présentée plus en détails dans le post consacré à de type d’acide.
Pour en savoir plus :
post d’introduction à la chimie
post sur les composants élémentaires
pst sur les électrons dans les liaisons covalentes
post sur les liaisons chimiques
post sur les ligands et la complexation
post sur l’oxydoréduction
post sur l’acide carboxylique
post sur l’eau
post sur les sels
post sur les métaux alcalins
post sur la classification périodique des éléments
glossaire de chimie générale
index
#chimie#acide#hydracide#oxacide#hydronium#arrhenius#bronsted#lewis#oxydation#réduction#oxydoréduction#redox#carboxylique#chlorhydrique#sulfurique#nitrique#ph#complexation
0 notes
Text
CHM205: Inorganic Chemistry Ii TMA4
CHM205: Inorganic Chemistry Ii TMA4 complete Question and answer
Question 1 : Mineral silicates plays an important role in national economy because from it is produced _______.
A. Plastics, ceramics,paints
B. Glass, paints,ceramics
C. Glass, ceramics,cement
D. Cement,plastics,glass
Answer to question I is C. Glass, ceramics,cement
Question 2 : Oxoacids in which the central atom is in a…
View On WordPress
0 notes
Text
Différence entre -ate et en -ite en chimie : la nomenclature des acides
Vous vous demandez ce qui détermine les terminaisons des acides en #chimie: en -ate ou en -ite, en -eux ou en -ique ? JeRetiens vous répond !
Les acides qui contiennent de l’oxygène et de l’hydrogène sont appelés oxacides, oxyacides, oxoacides ou encore acides ternaires. Ils sont caractérisés par leur formule générique HxXOy dans laquelle x est un élément chimique autre que l’oxygène (ou le fluor), généralement un métal de transition ou un non-métal fortement oxydé. Plus le rapport entre y et x est important, plus l’acide est fort.
Le…
View On WordPress
0 notes
Text
Long-term intake of ketogenic diets containing MCTs may additively enhance endurance training–induced increases in ketolytic capacity in skeletal muscle.
PMID: Nutrients. 2020 Apr 30 ;12(5). Epub 2020 Apr 30. PMID: 32365746 Abstract Title: Effects of a Ketogenic Diet Containing Medium-Chain Triglycerides and Endurance Training on Metabolic Enzyme Adaptations in Rat Skeletal Muscle. Abstract: Long-term intake of a ketogenic diet enhances utilization of ketone bodies, a particularly energy-efficient substrate, during exercise. However, physiological adaptation to an extremely low-carbohydrate diet has been shown to upregulate pyruvate dehydrogenase kinase 4 (PDK4, a negative regulator of glycolytic flux) content in skeletal muscle, resulting in impaired high-intensity exercise capacity. This study aimed to examine the effects of a long-term ketogenic diet containing medium-chain triglycerides (MCTs) on endurance training-induced adaptations in ketolytic and glycolytic enzymes of rat skeletal muscle. Male Sprague-Dawley rats were placed on either a standard diet (CON), a long-chain triglyceride-containing ketogenic diet (LKD), or an MCT-containing ketogenic diet (MKD). Half the rats in each group performed a 2-h swimming exercise, 5 days a week, for 8 weeks. Endurance training significantly increased 3-oxoacid CoA transferase (OXCT, a ketolytic enzyme) protein content in epitrochlearis muscle tissue, and MKD intake additively enhanced endurance training-induced increases in OXCT protein content. LKD consumption substantially increased muscle PDK4 protein level. However, such PDK4 increases were not observed in the MKD-fed rats. In conclusion, long-term intake of ketogenic diets containing MCTs may additively enhance endurance training-induced increases in ketolytic capacity in skeletal muscle without exerting inhibitory effects on carbohydrate metabolism.
read more
0 notes